1、选择题 常温下,对于1 L 0.005 mol·L-1硫酸表述中正确的是( )
A.由水电离出的c(H+)=1.0×10-12 mol·L-1
B.加水稀释后,溶液中所有离子的浓度均减少
C.2c(H+)=c(SO42-)+c(OH-)
D.滴加稀氨水使pH=7,则c(NH4+)=c(SO42-)
参考答案:A
本题解析:A项,硫酸电离出的c(H+)=10-2 mol·L-1,所以c(H+)水=1.0×10-12 mol·L-1正确;B项,加水稀释后,c(OH-)增大,错误;C项,H2SO4=2H++SO42-,H2O H++OH-,所以c(H+)=2c(SO42-)+c(OH-),错误;D项,根据电荷守恒判断,错误。
H++OH-,所以c(H+)=2c(SO42-)+c(OH-),错误;D项,根据电荷守恒判断,错误。
本题难度:一般
2、选择题 对pH=3的醋酸溶液和pH=3的HCl溶液等体积混和后,溶液的PH值?
A.PH<3
B.PH>3
C.PH="3"
D.无法确定
参考答案:C
本题解析:对醋酸来说:CH3COOH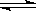 CH3COO- +H+
CH3COO- +H+
化学平衡常数K="[" CH3COO-][ H+]/[CH3COOH]
加入PH=3的盐酸,体积增加一倍,则 [ CH3COO-]和[CH3COOH]的浓度减少一倍,而K是定值不变,则K="[" CH3COO-][ H+]/[CH3COOH]中[ H+]不变,混合后溶液的PH=3
本题难度:一般
3、填空题 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液稀释.后向溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的如下图所示:
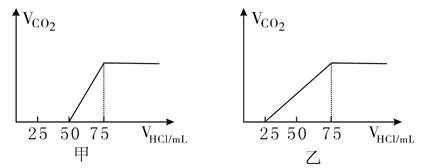
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是??,其物质的量之比是?, 产生的CO2气体体积(标况)是?. 在乙所得溶液中存在的溶质是?,其物质的量之比是?, 产生的CO2气体体积(标况)是?。
参考答案:甲:NaOH和Na2CO3、1:1、0.056 L;乙:Na2CO3和NaHCO3,1:1,0.112 L
本题解析:NaOH溶液中通入一定量的CO2,有几种情况:一种情况是CO2不足,反应后的混合物为NaOH,Na2CO3;另一种情况是二者恰好完全反应生成Na2CO3;第三种情况是CO2过量,全部NaOH转化为NaHCO3;第四种情况是CO2过量,反应后的混合物为NaHCO3和Na2CO3。
分析甲图像:加入盐酸50mL时开始产生CO2气体,至反应完毕消耗25mL盐酸,根据反应:
Na2CO3+HCl=NaHCO3+NaCl ①? NaHCO3+HCl=NaCl+H?2O+CO2↑②
可知滴加到50 mL时开始反应②,根据耗酸量可知NaHCO3的物质的量。分析图象加入50mL以前,无气体放出,与盐酸反应转化为NaHCO3应消耗25 mL盐酸,则与NaOH反应的盐酸也应是25 mL。由此得也甲成分只能为NaOH和Na2CO3,且物质的量之比为1:1,产生CO2的体积为0. 056L.

本题难度:一般
4、填空题 (7分)(1)室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于?
(2)室温时,将0.1 mol/L盐酸和0.07mol/L氢氧化钡溶液1:5(体积比)混合后,该混合溶液的pH=_______
(3)某温度时,0.1 mol·L-1NaOH溶液的pH=12。该温度下,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系____________________
参考答案: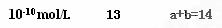
本题解析:略
本题难度:一般
5、选择题 在常温下,pH = 9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH─离子浓度分别为a和b,则a与b的关系为
A.a>b
B.a=10-4b
C.b =10-4 a
D.a =b
参考答案:B
本题解析:氢氧化钠是强碱,抑制水的电离,则由水电离产生的OH─离子浓度为10-9mol/L;醋酸钠是强碱弱酸盐,水解促进水的电离,则由水电离产生的OH─离子浓度为10-5mol/L,所以a与b的关系是a=10-4b,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导和训练,该题的关键是明确外界条件是如何影响水的电离平衡的,有利于培养学生的逻辑推理能力,提高学生的答题能力。
本题难度:一般