1、选择题 以下物质受热后均有气体产生,其中不产生红棕色气体的是
A.浓硫酸和溴化钠混合物
B.浓硝酸和木炭混合物
C.固体硝酸钙
D.浓硝酸
参考答案:C
本题解析:分析:A.?浓硫酸具有强氧化性,能氧化HBr生成红棕色的溴蒸气;
B.硝酸具有氧化性,能将单质碳氧化,硝酸被还原,生成二氧化氮和二氧化碳和水,二氧化氮气体为红棕色;
C.固体硝酸钙受热生成无色的氧气;
D.纯净的浓硝酸在常温下见光或受热就会分解,生成红棕色的二氧化氮气体.
解答:A.浓硫酸和溴化钠混合物受热后2NaBr+H2SO4(浓) Na2SO4+2HBr↑,浓硫酸具有强氧化性,易与HBr发生氧化还原反应,H2SO4(浓)+2HBr
Na2SO4+2HBr↑,浓硫酸具有强氧化性,易与HBr发生氧化还原反应,H2SO4(浓)+2HBr Br2↑+SO2↑+2H2O,生成的溴蒸气为红棕色,故A正确;
Br2↑+SO2↑+2H2O,生成的溴蒸气为红棕色,故A正确;
B.浓硝酸与木炭加热时发生氧化还原反应,碳被浓硝酸氧化成二氧化碳,浓硝酸被还原成二氧化氮,C+4HNO3(浓) 2H2O+CO2↑+4NO2↑,二氧化氮气体为红棕色气体,故B正确;
2H2O+CO2↑+4NO2↑,二氧化氮气体为红棕色气体,故B正确;
C.硝酸钙加热于132℃分解,加热至495~500℃时会分解为氧气和亚硝酸钙,生成的氧气为无色气体,故C错误;
D.硝酸化学性质不稳定,硝酸见光或受热分解,4HNO3 2H2O+4NO2↑+O2↑,生成的二氧化氮气体为红棕色,故D正确;
2H2O+4NO2↑+O2↑,生成的二氧化氮气体为红棕色,故D正确;
故选C.
点评:本题主要考查了硝酸、浓硫酸的化学性质,掌握常见的红棕色气体是解答本题的关键,平时须注意积累相关反应知识,题目难度不大.
本题难度:一般
2、选择题 据报道,我国已经有多个城市禁止生产和销售含磷洗衣粉(常含有三聚磷酸钠),主要原因是(?)
A.磷元素有毒
B.磷酸根离子水解使水体酸度增大
C.磷酸根离子与某些阳离子形成沉淀,使水体浑浊
D.含磷污水引起浮游生物大量繁殖,使水中溶解氧急剧减少,导致水体恶化
参考答案:D
本题解析:磷是水生生物重要的营养元素,含磷污水能引起浮游生物大量繁殖,使水中溶解氧急剧减少,导致水体恶化,造成赤潮现象。
本题难度:简单
3、填空题 金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
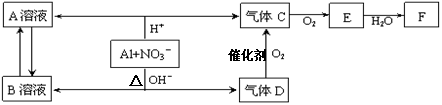
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,反应的离子方程式为?。
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C或E都转化为无毒的气态单质,任意写出其中一个反应的化学方程式?。
(3)写出铝在碱性条件下与NO3-反应的离子方程式?。
(4)除去气体C中的杂质气体E的化学方法:?(用化学方程式表示)
(5)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是?。
参考答案:(1)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分)
(2)8NH3+6NO2 7N2+12H2O 或4NH3+6NO
7N2+12H2O 或4NH3+6NO  5N2+6H2O(2分)
5N2+6H2O(2分)
(3)8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑ ?(2分)
(4)3NO2+H2O=2HNO3+NO(2分)?(5)1:1?(2分)
本题解析:
(1)A和B两溶液混合产生白色沉淀,由信息可知白色沉淀为氢氧化铝。
(2)能转化成无毒的物质,则该物质是氮气。
(3)由流程中的信息铝在碱性条件可以反应得到溶液,所以生成了偏铝酸根。
(4)杂质气体为二氧化氮,除杂时使用水即可。
(5)根据方程式,化合价升降守恒计算可得。
本题难度:一般
4、填空题 氮可以形成多种离子,如N3-、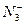 、
、 、
、 、
、 、
、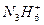 等,已知
等,已知 与
与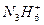 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于 的性质,另外氮与氢也能形成NH3、N2H4、N3H5、N4H6、N5H7……
的性质,另外氮与氢也能形成NH3、N2H4、N3H5、N4H6、N5H7……
(1)一个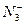 含有__________________________个电子,
含有__________________________个电子, 的电子式为____________。
的电子式为____________。
(2)形成 的中性分子的结构式是_____________________。
的中性分子的结构式是_____________________。
(3)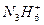 在强碱溶液中反应的离子方程式:_____________________________。
在强碱溶液中反应的离子方程式:_____________________________。
(4)NH3、N2H4、N3H5、N4H6、N5H7是否互为同系物,为什么?__________________________。
(5)写出N5H7可能的结构简式______________________________。
(6)这一系列化合物中N的质量分数最大值应小于____________%。
参考答案:(1)22? (各1分)
(各1分)
(2)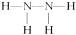 (2分)
(2分)
(3)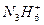 +OH-====N3H5+H2O(2分)
+OH-====N3H5+H2O(2分)
(4)互为同系物,因为它们的结构相似,组成上相差一个或若干个“NH”原子团(2分)
(5)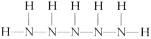 (2分)
(2分)
(6)93.3(2分)
本题解析:解答本题需要根据题目的条件对所学知识进行正向迁移,如果不能正确联系铵盐和同系物的知识,则必然会得出错误结论。因 与
与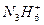 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于 的性质,所以可以通过氨气和铵离子进行迁移分析
的性质,所以可以通过氨气和铵离子进行迁移分析 与
与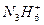 的性质。
的性质。
本题难度:简单
5、计算题 (9分) 在500mL? 0.2 mol·L-1的稀硝酸中加入1.92克铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(3)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol·L-1的氢氧化钠溶液?多少毫升?
参考答案:(1)设生成的气体是X(标准状况),则
3Cu?+? 8HNO3=3Cu(NO3)2+4H2O+2NO↑
3×64g? 8mol? 2×22.4L
1.92g? n(HNO3)? X
所以有x=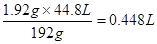
消耗硝酸n(HNO3)=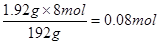
(2)原硝酸的物质的量是0.5L×0.2mol/L=0.1mol
所以剩余硝酸是0.1mol-0.08mol=0.02mol
则氢离子的浓度是0.02mol÷0.5L=0.04mol/L
(3)根据铜原子守恒可知,生成硝酸铜是1.92g÷64g/mol=0.03mol
因此反应后的溶液中含有0.02mol硝酸和0.03mol硝酸铜
所以要使溶液中的Cu2+全部转化为Cu(OH)2沉淀
需要氢氧化钠的物质的量是0.02mol+0.03mol×2=0.08mol
体积是0.08mol÷0.2mol/L=0.4L=400ml
本题解析:考查根据方程式进行的有关计算。
本题难度:一般