1、选择题 把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的3个装置,最后用排水法收集,假设氮的氧化物不与Na2O2反应,最后收集到_________________体积的气体,该气体的组成为________________。
参考答案:0.5? O2
本题解析:通过装有足量NaHCO3饱和溶液时,3 mol NO2与水反应生成2 mol硝酸和1 mol NO,2 mol硝酸可与足量NaHCO3反应生成2 mol CO2,通过浓H2SO4干燥后,剩余的气体是1 mol NO和2 mol CO2,2 mol CO2和Na2O2反应产生1 mol O2;在用排水法收集时,这两种气体会发生以下反应:4NO+3O2+2H2O====4HNO3,O2过量,剩余O2的物质的量为0.5 mol,所以最后剩余0.5体积O2。
本题难度:简单
2、填空题 (15分)1mol水蒸汽和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ ·mol-1。利用该反应生成的氢气和空气中的氮气合成氨,其反应的△H<0。氨可以用于制备硝酸。请回答:
(1)生成水煤气的热化学方程式是??;
(2)合成氨需要在较大的压力下进行的原因是??;
(3)温度过高或过低对合成氨的影响是??;
(4)由氨生成HNO3的各步反应的化学方程式是??;
(5)某化肥厂由NH3制备HNO3,进而生产硝铵(NH4NO3)。假设由氨氧化生成HNO3的总产率是85%,而HNO3和NH3完全反应生成NH4NO3。列式计算:
①从NH3制取NH4NO3过程中,用于中和硝酸所需的氨占总的氨消耗量的分数;
②若氨的消耗总量为100 kg,可生产NH4NO3的量。
参考答案:
(1)C(s)+H2O(g) CO(g)+H2(g),△H =" +131.4" kJ ·mol-1
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1
(2)合成氨是体积减少的反应,加大压力有利于平衡向生成氨的方向移动
(3)温度过低反应速率慢;合成氨为放热反应,温度过高反应向氨分解的方向进行
(4)4NH3+5NO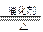 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO
(5)①中和硝酸所需的氨占总的氨消耗量的分数为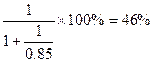
②可生产NH4NO3:100kg×46%× =216kg
=216kg
本题解析:(1)根据题目的叙述和书写热化学方程式的步骤和注意事项,很容易的写出生成水煤气的热化学方程式为C(s)+H2O(g) CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。
CO(g)+H2(g),△H =" +131.4" kJ ·mol-1,注意焦炭的状态为固体,反应吸热△H应为正值,反应的条件可以不用注明。
(2)工业合成氨的化学方程式为N2(g)+3H2(g)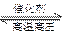 2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。
2NH3(g),反应的特点是:正反应为气体体积减小的放热反应。因此根据平衡移动原理,应采用较大的压强,使平衡向生成氨的方向移动。
(3)在工业上,选择反应条件是既要考虑反应速率,又要考虑反应的产率(即化学平衡);还要考虑催化剂的催化活性问题。因此在合成氨工业中采用的温度为700K,因为在此温度时催化剂——铁触媒的催化活性最高,同时温度过低反应速率太小,温度过高不利于平衡向生成氨的方向移动。
(4)工业制硝酸采用的是氨氧化法,其反应的化学方程式为4NH3+5NO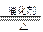 4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
(5)①根据题目要求可知反应的关系为NH3~HNO3、NH3+HNO3=NH4NO3,假设中硝酸所用的氨气的物质的量为1 mol,则中的硝酸为1 mol。根据题目生产硝酸时的总产率为85%,则生产这1 mol硝酸利用了氨的物质的量为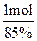 ,所以中和硝酸所需的氨占总的氨消耗量的分数为
,所以中和硝酸所需的氨占总的氨消耗量的分数为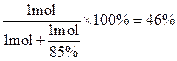 。
。
②根据上一问可知100kg氨中用于中和硝酸的氨有100kg×46%=46kg。则
NH3+HNO3=NH4NO3
17? 80
46kg?m(NH4NO3)
所以m(NH4NO3)=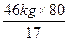 =216kg。
=216kg。
本题难度:一般
3、选择题 下列物质都具有较强的吸水性。欲使稀硝酸成为浓硝酸,不能使用的试剂是
A.浓硫酸
B.五氧化二磷
C.无水硫酸镁
D.甘油
参考答案:D
本题解析:A、浓硫酸具有吸水性,能使稀硝酸变为浓硝酸,A正确;B、五氧化二磷极易学吸水变为磷酸,所以能使稀硝酸变为浓硝酸,B正确;C、无水硫酸镁具有吸水性,能使稀硝酸变为浓硝酸,C正确;D、甘油是丙三醇与水互溶,不能使稀硝酸变为浓硝酸,D不正确,答案选D。
本题难度:简单
4、填空题 (6分) “神舟”7号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼〔(CH3)2N—NH2〕,氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是_______,产生该气体的化学反应方程式为
_________。
(2)偏二甲肼在N2O4中燃烧的化学方程式为_________________________,当有1 mol偏二甲肼燃烧时,转移电子的物质的量为___________。
参考答案:(1)NO2? N2O4 2NO2
2NO2
(2)(CH3)2N—NH2+2N2O4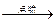 3N2+2CO2+4H2O? 16 mol
3N2+2CO2+4H2O? 16 mol
本题解析:本题以新信息为切入点考查了氧化还原的知识。由于所用氧化剂是N2O4,在N2O4中存在N2O4 2NO2平衡,所以逸出的红棕色气体是NO2。由题意可知(CH3)2N—NH2和N2O4是反应物,产物是氮气、二氧化碳和水。所以方程式:(CH3)2N—NH2+2N2O4
2NO2平衡,所以逸出的红棕色气体是NO2。由题意可知(CH3)2N—NH2和N2O4是反应物,产物是氮气、二氧化碳和水。所以方程式:(CH3)2N—NH2+2N2O4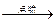 ?3N2+2CO2 +4H2O,由题意可知,N2O4→N2,化合价降低4,所以当有1 mol偏二甲肼燃烧时,转移电子的物质的量为2×2×4 mol="16" mol。
?3N2+2CO2 +4H2O,由题意可知,N2O4→N2,化合价降低4,所以当有1 mol偏二甲肼燃烧时,转移电子的物质的量为2×2×4 mol="16" mol。
本题难度:一般
5、选择题 下列食品添加剂与类别对应不正确的是(?)
A.调味剂——亚硝酸钠
B.防腐剂——苯甲酸钠
C.疏松剂——碳酸氢钠
D.着色剂——叶绿素
参考答案:A
本题解析:A、亚硝酸钠具有毒性,不能用作调味品,故A应用错误;
B、苯甲酸钠具有防腐性,可以用作防腐剂,故B应用正确;
C、碳酸氢钠受热能分解生成二氧化碳,可以使食品变得疏松,能用作疏松剂,故C应用正确;
D、叶绿素显示绿色,能用于着色剂,故D应用正确;
故选A.
本题难度:简单