1、实验题 下图是某化学学习小组用来探究钠与水反应的实验装置。该装置可以集反应、收集、检验气体的性质于一体。图中钠块是用大头针又住的。请填空
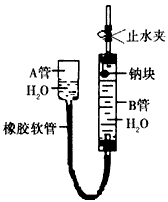
(1)①钠块的位置靠近B管上的胶塞,为了尽可能收集到纯净的气体,应先_____(填“打开”或“关闭”)止水夹,然后慢慢提升A管,待B管中钠块与水接触时,应立即______(填“打开”或“关闭”)止水夹;
②所以A管的作用是__________________。
(2)钠与水反应的化学方程式是___________________。
(3)①为了安全,钠与水反应产生的气体在点燃前应该______________,而该方法可以直接点燃这种气体,其原因是______________;
②点燃该实验中的气体的操作方法是先用明火靠近导气管口,然后打开止水夹,可以观察到气体的燃烧,该气体燃烧时的化学方程式是__________________。
参考答案:(1)①打开;关闭;②调节水面高度以控制钠块与水的接触
(2)2Na+2H2O=2NaOH+H2↑
(3)①检查氧气的纯度;收集到的氢气是比较纯净的;②2H2+O2 2H2O
2H2O
本题解析:
本题难度:一般
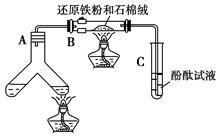
2、实验题 (12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。

(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是?_______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸? b.稀硫酸? c.盐酸? d.浓硫酸?
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
参考答案:(12分)
⑴在E的出口收集氢气验纯(或检验装置内氢气的纯度)(2分)
⑵3Fe+4H2O(气) ?Fe3O4+4H2(2分)
?Fe3O4+4H2(2分)
⑶b、c(1分)
⑷f-e:e/16(2分);无影响(1分);
(5)铜6.4g,氧化亚铜7.2g(4分)
本题解析:略
本题难度:简单
3、选择题 下列有关实验的叙述,正确的是
A.乙烷和氯气光照下制取纯净的氯乙烷
B.用分液漏斗分离环己烷和水的混合液体
C.用浓氨水洗涤做过银镜反应的试管
D.在苯和溴水的混合物中加入铁粉制取溴苯
参考答案:B
本题解析:乙烷和氯气光照发生取代反应,副产物多,不正确。环己烷不溶于水,利用通过分液进行分离,正确。银镜反应生成的银不溶于氨水,可以用硝酸除去。苯和液溴在催化剂的作用下生成溴苯,而不是溴水。所以答案是B。
本题难度:一般
4、实验题 如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl ?NH4NO2+NaCl
?NH4NO2+NaCl
②NH4NO2 NH3↑+HNO2
NH3↑+HNO2
③2HNO2 N2O3↑+H2O
N2O3↑+H2O
④2NH3+N2O3 2N2+3H2O
2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
N2和H2的体积比
| 5∶1
| 3∶1
| 1∶1
| 1∶3
| 1∶5
|
酚酞变红色所需时间/min
| 8~9
| 7~8
| 6~7
| 3~4
| 9~10
|
?
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式________________________。
(2)铁粉撒在石棉绒上的目的是_________________________________
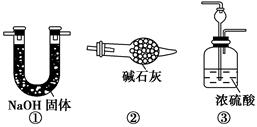
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是________________________。
请你另设计一个简单的实验验证你的理由____________________。欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和________之间。
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为________比较适宜;但该装置还难以实现此目的,原因是______________________________________。
(5)实验过程中通入试管C中的气体成分有________。
参考答案:(1)Zn+2H+=Zn2++H2↑
(2)增大混合气体与催化剂的接触面积,使反应进行得更快
(3)从分步反应可知,产生N2的过程中,有可能直接产生氨气 将混合加热产生的气体直接通入酚酞试液,若试液变红,则说明理由成立;否则,说明理由不成立 ③ A B
(4)1∶3 无法控制通入B中N2和H2的体积比
(5)NH3、N2、H2
本题解析:(1)根据Y形管右侧管需加热,说明右侧管反应制取N2,左侧管反应制取H2。(2)铁粉撒在石棉绒上的目的是增大与混合气体的接触面积,从而提高催化效率,增大反应速率。(3)因为NH4NO2分解可产生NH3,所以不能证明N2和H2反应生成了NH3。直接将Y形管中混合气体通入酚酞试液,若试液变红,则理由成立,否则理由不成立。在A、B之间加一个除NH3的装置,排除了NH3的干扰。(4)由表可知V(N2)∶V(H2)=1∶3时,反应最快,在Y形管中,无法控制气体的体积。(5)气体成分中有生成的NH3,同时还有未反应的N2、H2。
本题难度:一般
5、选择题 下列实验操作或方法中,正确的是
A.大量氯气泄漏时,迅速离开现场,并尽量往低处去
B.因为固体氯化钠溶解时热效应不大,所以可以在容量瓶中溶解氯化钠固体
C.用加热的方法分离氯化钠和氯化铵固体
D.用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质
参考答案:C
本题解析:A项:氯气的密度大于空气的密度,应往上去;B项:容量瓶是在常温下配置溶液的容器,不能用来反应或直接在里面溶液溶质;C项氯化钠加热不分解,氯化铵加热分解,可用加热的方法分离氯化钠和氯化铵固体:D项:过滤是除去不溶物的实验操作,而氯化钙和氯化镁都是可溶的杂质。故选C。
点评:基本的化学实验操作的考查。氯气的物理性质:是黄绿色的气体、氯气有毒、并有刺激性气味、密度比空气大、熔沸点较低、能溶于水易溶于有机溶剂、在压强为101kPa、温度为-34.6℃时易液化。如果将温度继续冷却到-101℃时,液氯变成固态氯。1体积水在常温下可溶解2体积氯气.氯气有毒,闻有毒气体气味的方法是(扇动法):用手轻轻在瓶口扇动,使极少量的气体飘进鼻孔。容量瓶是为配制准确的一定物质的量浓度的溶液用的精确仪器(注意:常温下),不能在其里面溶解物质,发生化学反应。
本题难度:简单