1、选择题 设计了四种制备气体的方案:①加热稀硫酸和乙醇制备乙烯;②加热稀盐酸和二氧化锰制备氯气;③用稀硫酸和大理石制备二氧化碳;④用稀硝酸和硫化亚铁制备硫化氢.不宜采用的方案有哪些?( )
A.只有①和②
B.只有②和③
C.只有③和④
D.①②③④
2、选择题 下列各组物质的水溶液不用其它试剂无法鉴别的是( )
A.NaOH?AlCl3
B.CuSO4BaCl2
C.NaAlO2?HCl
D.MgCl2?NaCl
3、实验题 某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1,?催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 催化剂的用量/ g
| KMnO4酸性溶液的浓度/mol?L-1
| 实验目的
|
①
| 298
| 0.5
| 0.01
| (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和③探究温度对该反应速率的影响;
(Ⅲ)实验①和______探究催化剂对该反应速率的影响
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| 0
| ?
|
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是________________
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是_______
A.硫酸钾? B.硫酸锰? C.二氧化锰? D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度?/?mol?L-1
| 溶液褪色所需时间?t / min
|
第1次
| 第2次
| 第3次
|
0.01
| 14
| 13
| 11
|
0.001
| 6
| 7
| 7
|
计算用0.001?mol?L-1?KMnO4酸性溶液进行实验时KMnO4的平均反应速率?(忽略混合前后溶液体积的变化)。
(4)?若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?_________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案_____________________________________
4、实验题 ⑴某实验小组为确认H2CO3、CH3COOH和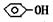 的酸性强弱,设计了下图装置,一次实验即可达到目的,请依据此实验填空:
的酸性强弱,设计了下图装置,一次实验即可达到目的,请依据此实验填空:
①锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂的名称是___________。
②装置F中所盛的试剂是__________,其作用是___________。
③装置G中发生反应的化学方程式是____________________。

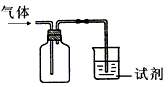
⑵下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是__________________。

5、实验题 某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO。

(1)补充完成下列实验步骤:
①_____________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止; ③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:可观察到的现象有:U型管左侧铜丝逐渐溶解,有__________色气体产生,溶液呈蓝色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为_____________。
(3)为了进一步证明反应确实生成的NO,还需要的操作及看到的现象为____________。
(4)将2.56?g?铜粉与100mL稀硝酸反应,充分反应后收集到标准状况下NO体积为1.12L,测得溶液中剩余NO3-的物质的量浓度为1.0mol/L,则原稀硝酸的物质的量浓度__________?(溶液体积变化忽略不计)。