1、简答题 现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
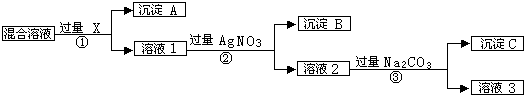
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X______,沉淀A______,沉淀B______.
(2)上述实验流程中加入过量的Na2CO3的目的是______.
参考答案:(1)如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl,
故答案为:BaCl2[或Ba(NO3)2];BaSO4;AgCl;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,
故答案为:除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3.
本题解析:
本题难度:一般
2、实验题 某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们好奇地对钠在CO2气体中燃烧进行了实验:
【实验过程】将玻璃燃烧匙中燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,说明可燃物燃烧的条件:_________________。
(2)要使燃烧的钠熄灭,可选用的灭火剂是___________。
A.水 B.干沙子 C.二氧化碳 D.四氯化碳
【探究问题】燃烧后瓶壁上附着的白色物质是什么?
【提出假设】①白色物质是Na2O2 ②白色物质是Na2CO3 ③白色物质是Na2O和Na2CO3的混合物。
【实验验证】该小组对燃烧后的白色物质进行如下探究

【思考讨论】
(3)①通过方案l和方案2的实验,你认为上述三个假设中,____成立。
②钠在二氧化碳中燃烧的化学方程式为______________________。
③丙同学认为白色物质有可能是氢氧化钠,否定他的观点的理由是_____________________。
【拓展思维】
(4)某碳酸钠粉末中可能含有少量的氢氧化钠和氯化钠,为检验该粉末中是否含有这些物质,某学生计划分六个步骤,其中四个步骤所用的试剂及实验操作已写明。请将下面表格里补写完整尚缺的②⑤两个步骤所用的试剂及实验操作。

参考答案:(1)一是与助燃物接触,二是可燃物必须达到着火点
(2)BD
(3)①假设②;②4Na+3CO2=2Na2CO3+C;③由实验①②可知(或反应物中无氢元素,或违背质量守恒定律)?
(4)②滴加稍过量的Ba(NO3)2溶液;⑤滴加稍过量的稀硝酸
本题解析:
本题难度:困难
3、选择题 下列有关实验操作的说法正确的是(?)
A.SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
B.用蒸馏水将PH试纸先润湿,可用于检验氨气
C.可用瓷坩埚熔化各种钠的化合物
D.某溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
参考答案:B
本题解析:A.SO2通入酸性高锰酸钾溶液中,溶液褐色,是由于二氧化硫将高锰酸钾还原为硫酸锰,致使其褪色,表现了二氧化硫的还原性:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
B.氨气为碱性气体,可使润湿的pH试纸呈蓝色
C.瓷坩埚中的二氧化硅可与强碱(NaOH)反应:SiO2+2NaOH=Na2SiO3+H2O
D.若原溶液中含有SO32-离子,加Ba(NO3)2溶液,再加入稀盐酸,依然可得到不溶于酸的BaSO4沉淀(NO3—在酸性溶液中可将SO32-离子氧化为SO42-,进而生成BaSO4沉淀),故错误
答案为B
本题难度:一般
4、实验题 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。?
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均 不带结晶水)
不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为?;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为?、?、?。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
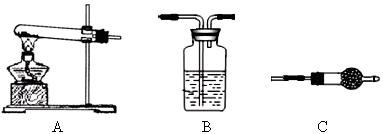
(1)各装置连接顺序为??→?→?。
(2)能证明生成物中有CuCO3的实验现象是?。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
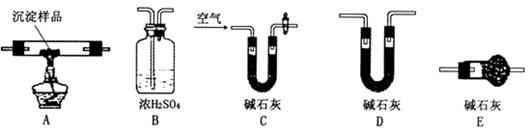

(1)装置C中碱石灰的作用是?,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是?
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为?。
参考答案:Ⅰ? CO32- +Cu2+ =CuCO3↓?过滤、洗涤、干燥?
Ⅱ(1)A→C→B?(2)装置B中澄清石灰水变浑浊
Ⅲ(1)吸收空气中的H2O 蒸汽和CO2?,
结束时通入的空气可以将装置中滞留的H2O 蒸汽和CO2赶出。?
(2)1-(49n/9m)?。
本题解析:略
本题难度:简单
5、实验题 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
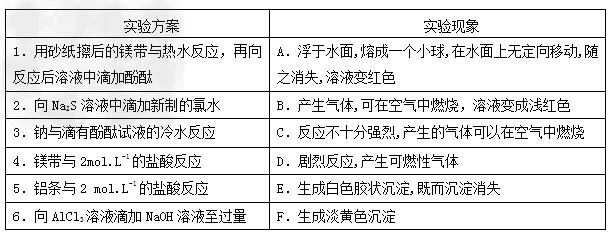
请你帮助该同学整理并完成实验报告﹕
(1 )实验目的:?;
(2 )实验用品:
仪器:①? __? ②?_ _? ③?___??④? ⑤镊子? ⑥小刀?⑦玻璃片? ⑧砂纸?⑨试管夹
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、Na2S 溶液、 AlCl3溶液、NaOH 溶液等。
(3 )实验内容:(填写与实验方案相对应的实验现象)
1? ? ? 2? ? 3? ? ? 4? ? ? 5? ? ? 6? ? ?(用A—F表示);
写出③的离子方程式? ? ;
(4)实验结论:? ? ;
参考答案:(1)探究同周期元素的金属性和非金属性的递变规律。?
(2)胶头滴管;烧杯;试管;酒精灯?
(3)1﹕B;?2﹕F;3﹕A;4﹕D;5﹕C;6﹕E?
? 2Na+2H2O=2Na++2OH-+H2↑?
(4)金属性:Na > Mg > Al?;非金属性:Cl > S
本题解析:
本题难度:一般