1、实验题 下图是某化学学习小组用来探究钠与水反应的实验装置。该装置可以集反应、收集、检验气体的性质于一体。图中钠块是用大头针又住的。请填空
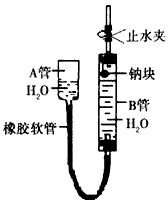
(1)①钠块的位置靠近B管上的胶塞,为了尽可能收集到纯净的气体,应先_____(填“打开”或“关闭”)止水夹,然后慢慢提升A管,待B管中钠块与水接触时,应立即______(填“打开”或“关闭”)止水夹;
②所以A管的作用是__________________。
(2)钠与水反应的化学方程式是___________________。
(3)①为了安全,钠与水反应产生的气体在点燃前应该______________,而该方法可以直接点燃这种气体,其原因是______________;
②点燃该实验中的气体的操作方法是先用明火靠近导气管口,然后打开止水夹,可以观察到气体的燃烧,该气体燃烧时的化学方程式是__________________。
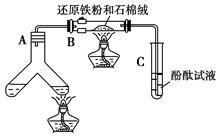
2、实验题 (12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。

(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是?_______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸? b.稀硫酸? c.盐酸? d.浓硫酸?
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
3、选择题 下列有关实验的叙述,正确的是
A.乙烷和氯气光照下制取纯净的氯乙烷
B.用分液漏斗分离环己烷和水的混合液体
C.用浓氨水洗涤做过银镜反应的试管
D.在苯和溴水的混合物中加入铁粉制取溴苯
4、实验题 如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl ?NH4NO2+NaCl
?NH4NO2+NaCl
②NH4NO2 NH3↑+HNO2
NH3↑+HNO2
③2HNO2 N2O3↑+H2O
N2O3↑+H2O
④2NH3+N2O3 2N2+3H2O
2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
N2和H2的体积比
| 5∶1
| 3∶1
| 1∶1
| 1∶3
| 1∶5
|
酚酞变红色所需时间/min
| 8~9
| 7~8
| 6~7
| 3~4
| 9~10
|
?
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式________________________。
(2)铁粉撒在石棉绒上的目的是_________________________________
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是________________________。
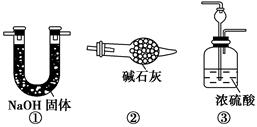
请你另设计一个简单的实验验证你的理由____________________。欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和________之间。
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为________比较适宜;但该装置还难以实现此目的,原因是______________________________________。
(5)实验过程中通入试管C中的气体成分有________。
5、选择题 下列实验操作或方法中,正确的是
A.大量氯气泄漏时,迅速离开现场,并尽量往低处去
B.因为固体氯化钠溶解时热效应不大,所以可以在容量瓶中溶解氯化钠固体
C.用加热的方法分离氯化钠和氯化铵固体
D.用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质