1、填空题 (13分)T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
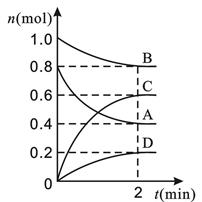
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正) v(逆)(填“>”“<”或“=”)。
参考答案:(1)2A+B 3C+D (3分,写“=”扣1分) (2)0.4(2分) (3)B、D(2分,漏选得1分、错选不得分)(4)1.69(2分)(5)C(2分)(6)=(2分,写“等于”不给分)
3C+D (3分,写“=”扣1分) (2)0.4(2分) (3)B、D(2分,漏选得1分、错选不得分)(4)1.69(2分)(5)C(2分)(6)=(2分,写“等于”不给分)
本题解析:(1)从图看出A、B物质的量减小,C、D物质的量增加,所以A、B是反应物,C、D是生成物,反应在2min时物质的量不再改变,说明是可逆反应,反应中A减少了0.4mol,B减少了0.2mol,C增加了0.6mol,D增加了0.2mol,根据反应物质的变化量之比等于化学计量数之比,则反应方程式为:2A+B 3C+D。(2)△c(A)="0.4mol÷0.5L=0.8mol/L," v(A)=0.8mol/L÷2min="0.4" mol·(min·L)-1。(3) A、B、C均为气态、D为固态,反应是气体物质的量不变的反应,不管是否达到平衡,压强不会改变,压强不变不能说明气反应达到了平衡,A错;反应体系中有气体和固体,如果反应没有达到平衡气体的质量发生改变,气体的密度也会改变,气体的密度不变说明气体的生成和消耗速率相等,则反应达到了平衡,B对;B是反应物,D是生成物,不管是否达到平衡,消耗0.1mol的B同时生成0.1mol的D,C错;B的物质的量不变说明B的生成和消耗速率相等,反应达到了平衡,D对。选AD。(4)T ℃时,该反应的平衡常数K=c3(C)/c2(A) ·c(B)=(0.6/0.5)3/(0.4/0.5)2 ·( 0.8/0.5)= 1.69。(5)增大 A的量,A的转化率减低,A错;D是固体,移走D对物质的浓度没有影响,平衡不发生移动,B错;反应是吸热反应,升高温度平衡向正向移动,A的转化率增大,C对;把容器的体积缩小一倍,相当于增大压强,平衡不移动,A的转化率不变,D错;选C。(6)QC= c3(C)/c2(A) ·c(B)=0.33/(0.22·0.4)=1.69=K,反应达到了平衡,则v(正)= v(逆)
3C+D。(2)△c(A)="0.4mol÷0.5L=0.8mol/L," v(A)=0.8mol/L÷2min="0.4" mol·(min·L)-1。(3) A、B、C均为气态、D为固态,反应是气体物质的量不变的反应,不管是否达到平衡,压强不会改变,压强不变不能说明气反应达到了平衡,A错;反应体系中有气体和固体,如果反应没有达到平衡气体的质量发生改变,气体的密度也会改变,气体的密度不变说明气体的生成和消耗速率相等,则反应达到了平衡,B对;B是反应物,D是生成物,不管是否达到平衡,消耗0.1mol的B同时生成0.1mol的D,C错;B的物质的量不变说明B的生成和消耗速率相等,反应达到了平衡,D对。选AD。(4)T ℃时,该反应的平衡常数K=c3(C)/c2(A) ·c(B)=(0.6/0.5)3/(0.4/0.5)2 ·( 0.8/0.5)= 1.69。(5)增大 A的量,A的转化率减低,A错;D是固体,移走D对物质的浓度没有影响,平衡不发生移动,B错;反应是吸热反应,升高温度平衡向正向移动,A的转化率增大,C对;把容器的体积缩小一倍,相当于增大压强,平衡不移动,A的转化率不变,D错;选C。(6)QC= c3(C)/c2(A) ·c(B)=0.33/(0.22·0.4)=1.69=K,反应达到了平衡,则v(正)= v(逆)
考点:化学反应图像,反应速率的计算、平衡状态的判断、平衡的移动和反应方向的判断。
本题难度:一般
2、选择题 在一定条件下,N2与H2发生如下反应:N2 + 3H2 2NH3 ,影响该反应速率的最主要因素(?)
2NH3 ,影响该反应速率的最主要因素(?)
A.浓度
B.温度
C.N2和H2的性质
D.催化剂
参考答案:C
本题解析:反应物能不能发生化学反应以及反应的快慢,首先决定于反应物的性质。
本题难度:简单
3、选择题 对H2(g)+I2(g)?
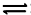
2HI(g)?反应,如图所示若a表示υ(H2)消耗,则b可表示( )
A.υ(I2)消耗
B.υ(HI)生成
C.υ(HI)消耗
D.υ(H2)生成