1、计算题 油画置于空气中,天长日久就会生成黑色的PbS从而使油画的色彩变暗,若用H2O2来“清洗”,则可使PbS转变为白色的PbSO4,从而使油画“复原”。?
(1)请写出“清洗”反应的化学方程式,此反应体现了H2O2的什么性质??
(2)若有0.100 mol的PbS参与反应,则在此反应中发生转移的电子的物质的量为_________mol。?
参考答案:(1)PbS+4H2O2====PbSO4+4H2O;体现了H2O2的氧化性。
(2)0.800
本题解析:写出题设条件下发生反应的化学方程式是解决(1)(2)两问的关键。
(1)从题意来看反应物是明确的,应是PbS和H2O2;H2O2具有强氧化性,使PbS中-2价的S变为PbSO4中+6价的S,H2O2中-1价的O得电子后变为-2价,所以生成物应是PbSO4和H2O。于是得方程式为:PbS+4H2O2====PbSO4+4H2O。
(2)由(1)得PbS与转移电子的关系:
PbS~8e-
则转移电子的物质的量为:n(e-)=8n(PbS)="0.800" mol。
本题难度:简单
2、选择题 向某盐溶液中加入BaCl2溶液,再加入稀HNO3至溶液呈酸性,有白色沉淀产生,该溶液中可能有( )?
A.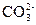
B.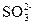
C.Ag+
D.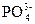 ?
?
参考答案:BC
本题解析:四种阴离子与Ba2+反应的产物分别是BaCO3、BaSO3、AgCl、Ba3(PO4)2,再加稀HNO3,BaCO3和Ba3(PO4)2能溶于其中,BaSO3能被稀HNO3氧化为BaSO4,BaSO4、AgCl不溶于稀HNO3。
本题难度:简单
3、选择题 下列实验能证明SO2存在的是(?)
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成 ,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成
A.都不能证明
B.③④⑤能证明
C.③⑤能证明
D.只有⑤能证明
参考答案:D
本题解析:CO2也能使澄清的石灰水变混浊,①不能证明;能使湿润的蓝色石蕊试纸变红,只能说明该气体溶于水显酸性,不能证明SO2的存在;氯气也能使湿润的品红试纸褪色,③不能说明。④中CO2也是符合的,不能证明SO2的存在。SO2气体检验还原性,能被氯水氧化生成硫酸,硫酸和氯化钡反应生成白色沉淀硫酸钡,因此⑤可以证明,答案选D。2检验的有关判断
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题也有利于培养学生的规范实验操作能力和实验安全意识。
本题难度:一般
4、实验题 分某同学为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验

(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请在答题卷上把导管补充
完整?。
(2)请写出铜跟浓硫酸反应的化学方程式?。
(3)实验中D中的现象?。
(4)实验中,该同学取6.4g铜片和12mL 18mol·L-1H2SO4溶液放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余;该同学根据所学的化学知识判断还会有一定量H2SO4的剩余,下列药品中能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是?填字母编号)。
a.BaCl2溶液? b.Ba(NO3)2溶液? c.银粉? d.Na2CO3粉末
(5)若将16g铜与50mLH2SO4物质的量浓度为一定值的浓硫酸反应,铜完全溶解。请回答:
①反应中产生的气体在标准状况下的体积为?L。
②该反应中被还原的H2SO4的物质的量为?mol。
③待产生的气体全部释放后,向溶液中滴加VmL a mol·L-1NaOH溶液,恰好使溶液中?
的Cu2+全部转化为沉淀,则原浓硫酸中H2SO4的物质的量浓度=?mol·L-1。
参考答案:
(1)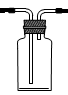 (2)
(2)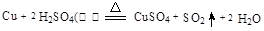
(3)紫色石蕊试液变红?(4)bd?(5)① 5.6;② 0.25;③(aV×10-2+5)
本题解析:(1)作图时B装置中导气管长进短出;(2)铜与浓硫酸反应生成二氧化硫和硫酸铜,注意配平;(3)二氧化硫溶于水,得到的的溶液显酸性?,紫色石蕊试液变红;(4)能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是b、d,a.反应后生成的硫酸铜中也含有硫酸根离子,能与BaCl2溶液生成白色沉淀,不能检验出硫酸的存在;b.如果溶液中有硫酸剩余,加入Ba(NO3)2溶液,除了生成白色硫酸钡沉淀,还会在烧瓶口处观察到红棕色的NO2气体,故能检验出硫酸的存在;c.加入银粉没有明显变化,不能检验出硫酸的存在;d.如果溶液中有硫酸剩余,加入Na2CO3粉末会生成无色的CO2气体,故能检验出硫酸的存在;(5)①根据铜的质量,利用铜与硫酸反应的化学方程式计算;②根据元素守恒,被还原的H2SO4的物质的量等于生成SO2的物质的量;③“恰好使溶液中的Cu2+全部转化为沉淀”,则此时,溶液为Na2SO4溶液,根据硫元素守恒,则硫酸的物质的量:n(H2SO4)=n(Na2SO4)+n(SO2)=n(NaOH)×1/2+n(SO2),然后根据c=n/V(aq)计算。
本题难度:一般
5、选择题 在硫酸的工业制法中,下列生产操作与生产操作的主要原因
的说明都正确的是(?)
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
参考答案:D
本题解析:选项A中操作正确,但解释不正确,因为将矿石粉碎的目的是增大矿石与空气的接触面积,使之燃烧充分且完全;B选项的解释不对,因为净化炉气的目的是防止杂质使催化剂中毒和腐蚀管道;C选项的解释不对,因为使用催化剂的目的是加快化学反应的速率,并不能影响化学平衡,也就不能影响转化率。
本题难度:一般