1、计算题 (6分)将3.2 g Cu与足量的浓硫酸在加热条件下充分反应。
(1)其中被还原的硫酸的物质的量为?。
(2)把反应后的溶液稀释至500 mL,取出50 mL,向其中加入足量的BaCl2溶液,得到沉淀20.97 g,则稀释后所得溶液中SO42-的物质的量浓度为?。
(3)若浓硫酸中含溶质为b mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n (H2SO4)?0.5 b mol(填“>”、“<”或“=”)。
参考答案:(6分)(1)0.05mol? (2) 1.8mol/L? (3) <
本题解析:
答案:(1)0.05mol? (2) 1.8mol/L? (3) <
解析:3.2 g Cu为0.05mol
由方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O可知:
CuSO4+SO2↑+2H2O可知:
(1)?其中被还原的硫酸的物质的量为0.05mol,与被还原的铜相同。
(2)?稀释后所得溶液中SO42-的物质的量浓度为20.97 g÷233g/mol÷0.050L=1.8mol/L
(3)?随反应的进行浓硫酸变成稀硫酸,不再与铜反应,被还原的硫酸的物质的量n (H2SO4)<0.5 b mol
本题难度:简单
2、选择题 某元素A的气态氢化物受热分解后,能生成H2和一种固体物质,已知相同条件下分解后气体的体积为分解前气体体积的2倍,又知分解前后气体式量比为16:1,则可知A的相对原子量为
A.12
B.15
C.28
D.32
参考答案:C
本题解析:略
本题难度:简单
3、填空题 为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2 SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):

(1)实验过程中有关反应的离子方程式为? ?
?
?;
(2)由I组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为
?L;
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比?;
(4)欲计算该NaOH溶液的物质的量浓度应选择第?组数据,由此求得NaOH溶液的物质的量浓度为?。
参考答案:(1)H+?+ OH— = H2O?NH4+? +? OH- ="?" NH3 + H2O?
(2)? 0.84?L;(3)? 1:4?;(4)?Ⅲ???5.0 mol/L
本题解析:略
本题难度:一般
4、实验题 现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
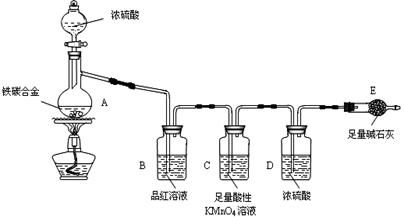
I?测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ?探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
参考答案:(1)把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管产生一段水柱(2分);(其他合理答案同样给分)
(2)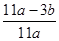 ×100% 或
×100% 或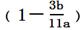 ×100%(2分);注意表达式有多种
×100%(2分);注意表达式有多种
(3)除去CO2中的SO2(1分);
(4)空气中CO2、H2O进入E管使b增大。(2分)
(5)在装置E的后边再连接一个与E相同的装置(2分)
反应产生的CO2气体未能完全排到装置E中,导致b偏低。(2分)
(6)常温下,Fe被浓H2SO4钝化,碳不与浓H2SO4反应(2分);
(7)2Fe + 6 H2SO4(浓) Fe2(SO4)3+ 3SO2↑ + 6H2O(2分);
Fe2(SO4)3+ 3SO2↑ + 6H2O(2分);
本题解析:(2)在装置A中发生Fe和C与浓硫酸的反应,产生CO2、SO2和铁的氧化物,装置B检验SO2,装置C吸收SO2,装置D干燥气体的,装置E是吸收CO2的,E增重的质量b是CO2的质量。
C---------CO2
1?1
b/44? b/44? C的质量:12b/44="3" b/11? Fe质量分数:(a-3 b/11)/a)×100%=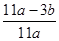 ×100%
×100%
(4)b的质量越大,碳的质量大,a不变,铁的质量会减小。
(5)再连接一个装置E是为了吸收充分的CO2。
本题难度:一般
5、选择题 下列关于硫酸性质的描述中,正确的是
A.浓H2SO4有氧化性,稀H2SO4无氧化性
B.由于浓H2SO4具有脱水性,所以可用做干燥剂
C.稀H2SO4与铜不反应,浓H2SO4在加热条件下可与铜反应
D.在受热的情况下浓硫酸也不与铁、铝发生反应
参考答案:C
本题解析:A不正确,稀硫酸中的氢元素能体现氧化性。浓硫酸具有吸水性,可用作干燥剂,B不正确。在加热的条件下浓硫酸和铁、铝等发生氧化还原反应,D不正确,正确的答案选C。
本题难度:一般