1、选择题 将m mol A 与n mol B 充入一密闭容器中,发生反应如下:m A(g) + n B(g)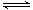 p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
A.A1<A2
B.A1=A2
C.A1>A2
D.不能确定
参考答案:C
本题解析:
正确答案:C
因为反应放热,在绝热、恒容下温度升高,平衡逆向移动,转化率变小,C正确。
本题难度:一般
2、选择题 下列说法正确的是(?)
A.化学反应中化学能只可以转化为热能
B.可逆反应达到平衡后,正、逆反应速率均为0
C.N?2和H2反应达到平衡后,无N?2或H2剩余
D.化学反应中一定有化学键的断裂和形成
参考答案:D
本题解析:在化学变化中好想你也可以转化为其它形式的能,例如光能,A错误。可逆反应达到平衡后,正、逆反应速率相等,但不为0,B错误。可逆反应的转化率不可能是100%的,因此平衡后,一定有氮气和氢气。选项D属于化学变化的本质,正确,答案D。
本题难度:一般
3、计算题 将等物质的量的A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)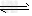 xC(g)?+2D(g),经5?min后,测得D的浓度为0.5?mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1?mol/(L
xC(g)?+2D(g),经5?min后,测得D的浓度为0.5?mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1?mol/(L min)。求:
min)。求:
(1)反应开始前放入容器中的A、B的物质的量。
(2)x的值。
(3)B的平均反应速率。
参考答案:(1)3mol
(2)x=2
(3)v(B)=0.05?mol/(L min)?。
min)?。
本题解析:
本题难度:一般
4、选择题 将2.0molPCl3,和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)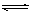 PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
A.0.40mol
B.小于0.20mol
C.0.20mol
D.大于0.20mol,小于0.40mol
参考答案:B
本题解析:如果平衡时移走1.0molPCl3和0.50molCl2,就相当于开始只加入了1.0molPCl3,和0.50molCl2。与开始加入2.0molPCl3,和1.0molCl2达到平衡时,PCl5为0.40mol比较,也就是减少了反应物的浓度。假如平衡不移动,加入了1.0molPCl3,和0.50molCl2反应物的物质的量减半,生成物的物质的量也要是减半。。达到平衡时,PCl5为0.20mol,但根据平衡移动原理:增大反应物的浓度,化学平衡向正反应方向移动,减小反应物的浓度,平衡会想逆反应方向移动。所以平衡时移走1.0molPCl3和0.50molCl2在相同温度下再达平衡时PCl5的物质的量应该比0.20mol要小。选项为B。
本题难度:一般
5、填空题 (10分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是?。
(3)吸收液吸收SO2的过程中,pH随n(SO3?﹣),n(HSO3﹣)变化关系如下表:
n(SO3?﹣):,n(HSO3﹣)
| 91:9
| 1:1
| 1:91
|
PH
| 8.2
| 7.2
| 6.2
|
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
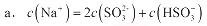

(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
参考答案:(1)SO2+H2O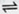 H2SO3? 2H2SO3+O2
H2SO3? 2H2SO3+O2 2H2SO4
2H2SO4
(2)2OH-+ SO2=H2O+SO32-?
(3)①酸性? HSO3-存在:HSO3-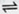 H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O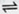 H2SO3+OH-,HSO3-的电离程度强于水解程度。? ②a b
H2SO3+OH-,HSO3-的电离程度强于水解程度。? ②a b
(4)①HSO3-+H2O-2e-= SO42-+3H+?
②H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液就可以再生。
本题解析:(1)SO2形成硫酸型酸雨时,二氧化硫和空气中的水、氧气反应得到硫酸:SO2+H2O H2SO3,2 H2SO3+O2
H2SO3,2 H2SO3+O2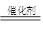 2H2SO4;
2H2SO4;
(2)二氧化硫被氢氧化钠溶液吸收制备亚硫酸钠溶液时:SO2+2OH- =SO32-+H2O;
(3)根据表中数据,可知,n(SO3?﹣):n(HSO3﹣)=1:91时,溶液的pH值为酸性,故NaHSO3溶液显酸性,在亚硫酸氢钠溶液中HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性。当吸收液呈中性时,溶液中的c(H+)=c(OH-),由于溶液中存在着电荷守恒,故c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),可推出:c(Na+)=2c(SO32-)+c(HSO3-),a对;由于n(SO?﹣):n(HSO?﹣)=1:1时,溶液的pH值为7.2,故中性时一定有c(HSO3-)> c(SO32-),可推出:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-),b对;
SO32-+H+和HSO3-+H2O=H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液呈酸性。当吸收液呈中性时,溶液中的c(H+)=c(OH-),由于溶液中存在着电荷守恒,故c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),可推出:c(Na+)=2c(SO32-)+c(HSO3-),a对;由于n(SO?﹣):n(HSO?﹣)=1:1时,溶液的pH值为7.2,故中性时一定有c(HSO3-)> c(SO32-),可推出:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-),b对;
(4)根据电解槽所示的变化,可知HSO3-在阳极放电的电极反应式是:HSO3-+H2O-2e- =3H++SO42-;H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
点评:本题综合性强,难度较大,主要考查学生分析解决问题的能力
本题难度:困难