1、计算题 (10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) ="====" 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
2、选择题 将1mol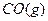 和1mol
和1mol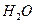 充入某固定容积的反应器中,在一定条件下,
充入某固定容积的反应器中,在一定条件下,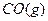 +
+
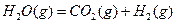 达到一定反应限度时有2/3的
达到一定反应限度时有2/3的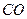 转化成
转化成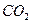 ,在相同条件下,将1mol
,在相同条件下,将1mol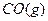 和2mol
和2mol 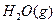 充入同一反应器中,当反应达到同一反应限度混合气体
充入同一反应器中,当反应达到同一反应限度混合气体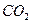 的体积分数可能是
的体积分数可能是
A.22.2%
B.28.2%
C.33.3%
D.37.8%
3、选择题 在2CH4+2NH3+3O2=2HCN+6H2O反应中,同一时间内测得v(O2)为b?mol·L-1·min-1?,v(HCN)为a?mol·L-1·min-1?,则a与b的关系为
A.b =1/2 a
B.b =2/3 a
C.b =3/2 a
D.b =2 a
4、选择题 在体积一定的密闭容器中进行如下反应:X2(g)+2Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是
2Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是
[? ]
A.b ≤ 0.1mol/L
B.达平衡时,X2的正反应速率与Y2的逆反应速率相等
C.a ≥ 0.05 mol/L
D.该平衡时气体物质的量浓度之和小于(a+ b+0.2)mol/L.
5、填空题 (10分)甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2?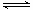 ?CH3OH
?CH3OH
图1表示该反应进行过程中的能量变化:

图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式?。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为?;10min后,容器内的压强变为原来的?倍;改变下列条件,能提高CO转化率的是?。
CH3OH(g)的平衡常数为?;10min后,容器内的压强变为原来的?倍;改变下列条件,能提高CO转化率的是?。
A.降低温度 B.加催化剂?
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2?
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:c(HCOO-)<c(Na+)时,则反应的情况可能为?。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应?
C.NaOH过量