1、选择题 一定条件下,对于反应N2+3H2?2NH3来说,下列反应速率中最快的是( )
A.V(H2)=0.6mol/(L?min)
B.V(N2)=0.3mol/(L?min)
C.V(H2)=0.01mol/(L?s)
D.V(NH3)=0.5mol/(L?min)
2、选择题 一定温度下,固定容积的密闭容器中进行的可逆反应:A(g)+2B(g)  ?C (g)+D(g),当下列物理量不再改变时,表明反应已达平衡的是
?C (g)+D(g),当下列物理量不再改变时,表明反应已达平衡的是
A.混合气体的密度不变
B.A的消耗速率与D的生成速率相同
C.单位时间内有1 mol A生成的同时,有1 mol C 消耗
D.混合气体的相对分子质量不变
3、选择题 冰醋酸CH3COOH沸点较高(117.9℃),且能形成二聚物(CH3COOH)2,其反应式为2CH3COOH(g)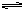 ? (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
? (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用
A.高温低压
B.低温低压
C.加催化剂
D.低温高压
4、填空题 (12分)在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g)  3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1) 该反应在30℃时平衡常数K1=?,焓变△H?0(填“>”、“<”或“=”)。
(2) 该反应在30℃时平衡混合气中C的体积分数为ω1=??;从反应开始到达到化学平衡状态时v(A)=____________mol/(L·min)
(3) 该反应在70℃时平衡常数为K2,则 K1?K2(填“>”、“=”或“<”)
(4) 可以判断2A(g)+3B(g)  3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )
A.2v(B)=3v(A)?
B.密闭容器中总压强不变
C.n(A)∶n(B)∶n(C)=2∶3∶3?
D.混合气体的平均相对分子质量不再改变
5、选择题 下列事实能用勒夏特列原理来解释的是
A.由H2、I2、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.将木炭粉碎后与O2反应,速率更快