1、推断题 各物质之间的转换关系如下图,部分生成物省略。
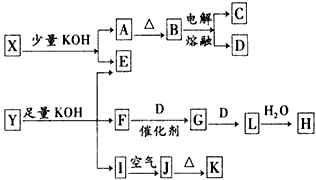
已知:
①常温下,D、F、G、L为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊。
请回答下列问题:
(1)写出F的电子式:________;
(2)写出化学式:X、__________、Y________;
(3)写出C与KOH液反应的化学方程式:________________;写出H的稀溶液与I反应的离子方程式:
____________________。
参考答案:(1)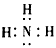
(2)Al2(SO4)3或KAl(SO4)2[或KAl(SO4)2·12H2O ];(NH4)2Fe(SO4)2[或(NH4)2Fe(SO4)2·6H2O]
(3)2Al+2KOH+2H2O==2KAlO2+3H2;3Fe(OH)2 +10H+ +NO3- = 3Fe3+ +NO↑ +8H2O
本题解析:
本题难度:一般
2、填空题 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G?的浓溶液中会钝化;F的溶液中只含一种溶质.
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是______,R、X、T的原子半径从小到大的顺序为:______(用元素符号表示);T与X形成的化合物T2X2含有的化学键类型是:______.
(2)A和G等物质的量反应生成的产物的水溶液显______性,其原因用离子方程式表示为______;
(3)A和X2反应的化学方程式为______;金属甲与D溶液反应生成F的离子方程式为:______.
(4)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和一氧化碳反应转化为两种空气的成分,当有22.4L的E(标准状况)转化时,转移的电子数为______NA.
参考答案:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色判断为NH3,D为碱,G为酸,金属甲在G 的浓溶液中会钝化,说明金属甲可能是铝、铁,酸可以是浓硫酸或浓硝酸;转化关系中金属甲能和碱D反应,判断甲为Al,D为强碱;A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍,原子序数可以为3或8;R和X相邻说明是Be或N、F;Q和T同主族,Q为非金属元素,T为金属元素,只能是第一主族,Q为H,T为Na,R为N,X为O;推断为:A、NH3,B、H2O,T为Na,D为NaOH,F为NaAlO2;C为NO,E为NO2,G为HNO3;(1)X为氧元素,在周期表中的位置是:第二周期,ⅥA族,R(N)、X(O)、T(Na)的原子半径从小到大的顺序为:Na>N>O,T与X形成的化合物是Na2O2含有的化学键类型是:离子键、非极性共价键,
故答案为:第二周期,ⅥA族;Na>N>O;离子键、非极性共价键;
(2)A(NH3)和G(HNO3)等物质的量反应生成的产物为硝酸铵,铵根离子水溶液水解呈酸性,原因为NH4++H2O?NH3?H2O+H+,故答案为:酸性;NH4++H2O?NH3?H2O+H+;
(3)A(NH3)和X2(O2)反应的化学方程式为:4NH3+5O2催化剂.△4NO+6H2O;金属甲(Al)与D(NaOH)溶液反应生成F的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(4)安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2NO2+4CO=N2+4CO2,当有22.4L的E(标准状况)物质的量为1mol,每2molNO2反应转化电子8mol,所以1molNO2反应转移的电子数为4×6.02×1023,故答案为:2.408×1024.
本题解析:
本题难度:一般
3、填空题 A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

回答下列问题:
(1)若A是非金属单质,X是强氧化性单质,C与水反应生成酸。则X是 ,A可能是 ;
(2)若A是强酸,X是金属单质,向C的水溶液中滴加BaCl2溶液不产生沉淀。则A是 ,X是 ;
(3)若A是一种铁矿石,反应①和②都是工业制硫酸生产中的重要反应,C与水反应生成强酸D。则工业生产中反应①发生的设备名称是 ,铜与D在一定条件下发生反应的方程式是 。
参考答案:(1)O2(1分), C或S或N2 (1分,写出一种即可)
(2)HNO3(1分);Fe(1分);
(3)沸腾炉(1分),Cu+2H2SO4 CuSO4+SO2↑+2H2O (2分)。
CuSO4+SO2↑+2H2O (2分)。
本题解析:(1)如果A是非金属,则符合条件的应该是S和氧气反应生成SO2,SO2继续和氧气反应生成三氧化硫,三氧化硫溶于水生成硫酸。或者是C→CO→CO2→H2CO3、N2→NO→NO2→HNO3。
(2)如果X是金属,则应该是变价的金属元素,所以是铁。C的水溶液中滴加BaCl2溶液不产生沉淀,则A是硝酸,而不是浓硫酸。
(3)铁矿石可用来生产硫酸,所以反应①中设备是沸腾炉,铜浓硫酸反应的方程式为Cu+2H2SO4 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
本题难度:一般
4、填空题 .(12分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
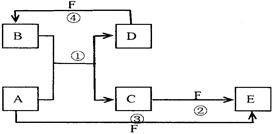
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有有色气体生成,则C的电子式为?,反应④的化学方程式为:??。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是?,用电子式表示B分子的形成过程?。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为?,分子E的结构式为?。
参考答案:(1)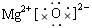 ? C+4HNO3(浓)
? C+4HNO3(浓)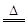 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)2Fe2++Cl2=2Fe3++2Cl-?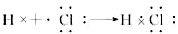
(3)2C+SiO2 2CO↑+Si? O=C=O
2CO↑+Si? O=C=O
本题解析:本题是无机框图题,关键是找准突破点。
(1)根据AD的原子结构可知,A是镁,D是碳。F的浓溶液与A、D反应都有有色气体生成,说明F是硝酸。所以B是CO2,C是氧化镁,E是硝酸镁。碳和浓硝酸反应的方程式为C+4HNO3(浓)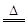 CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(2)根据反应②③可知,A应该是变价金属铁,所以B是盐酸,D是氢气,C是氯化亚铁,E是氯化铁。因此反应②的方程式为2Fe2++Cl2=2Fe3++2Cl-;氯化氢是由极性键形成的共价化合物,所以其形成过程可表示为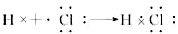 。
。
(3)A、D所含元素同主族,则符合条件的是碳、硅或O、S。根据反应②③可知,A应该是碳,B是二氧化硅,D是硅,C是CO,E是CO2,所以反应①的方程式为2C+SiO2 2CO↑+Si;CO2是由极性键形成的直线型分子,结构式是O=C=O。
2CO↑+Si;CO2是由极性键形成的直线型分子,结构式是O=C=O。
本题难度:一般
5、填空题 气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中的常见气体。各物质有如下图所示的转化关系:
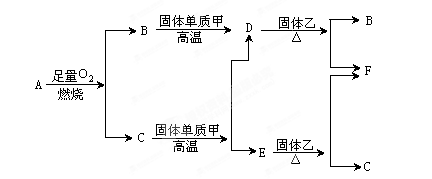
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有( )(写化学式)
(2)若气体A的分子为线形结构,且X与Y的质量比在数值上等于X的相对原子量,则A的化学式为( )
(3)写出化学式:B________ C________ D________ E________ 甲________
参考答案:(1)H2(2)C2H2(3)CO2;H2O;CO;H2;C。
本题解析:
【错解分析】推断题的解题关键在于抓住突破口。
【正解】本题突破口不是很明显。可以从气体A入手。题中A气体只含X、Y两种短周期元素且可燃,符合这两个条件的无机气体为H2、CO、H2S;有机气体为气态烃。确定大范围之后,再向下思考排除。这些气体只可能含C、H、O、S中的两种元素,燃烧产物只可能为CO2、H2O或SO2。B、C都能和固态单质甲高温反应生成气体,这样较易想到CO2、H2O都可以高温与碳单质反应,CO2+C CO+H2,从而确定了B为CO2,C为H2O,D为CO,E为H2,甲为碳单质,X为碳元素,Y为氢元素。(1)中若X、Y的质量比等于3,A化学式为CH4,但其质量比小于3,含氢量更高,只能含H2。(2)中A也只能为C2H2了。
CO+H2,从而确定了B为CO2,C为H2O,D为CO,E为H2,甲为碳单质,X为碳元素,Y为氢元素。(1)中若X、Y的质量比等于3,A化学式为CH4,但其质量比小于3,含氢量更高,只能含H2。(2)中A也只能为C2H2了。
本题难度:一般