1、填空题 已知在一定条件下,2mol H2完全燃烧生成液态水时放出热量572kJ,请回答下列问题:
(1)反应物的总能量 ? (填“大于”、“小于”或“等于”)生成物的总能量。
(2)在此条件下,若反应生成含1molO-H键的液态水,则放出热量为?kJ;若2 mol氢气完全燃烧生成水蒸气,则放出的热量?(填“>”、“<”或“=”)572 kJ。
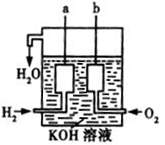
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成,一极通入H2 ,另一极通入O2,则?(填物质化学式)失电子作负极;正极电极反应式为:?;电池总反应为:??。
参考答案:(每空1分,共6分)
(1)大于?(2)143?;< (3) H2 ;O2 + 2H2O+ 4e-= 4OH- ;2H2+O2 =2H2O
本题解析:(1)因放热反应中生成物能量总<与反应物能量总和,而2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol是放热反应,故答案为:小于;
(2)据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol,若反应生成含1molO-H键的液态水,则放出热量为143 kJ。2mol氢气完全燃烧生成液态水放出热量572kJ,因液态水变成水蒸气需要吸热,所以2mol氢气完全燃烧生成水蒸气放出热量小于572kJ,故答案为:<.
(3)因燃料电池的总反应为:2H2+O2=2H2O,通入负极的是H2,通入正极的是O2,电极反应式:O2+4e-+2H2O=4OH-,电池总反应为2H2+O2 =2H2O。
点评:本题考查学生燃料电池的相关知识,可以根据所学内容来回答,难度不中。
本题难度:一般
2、选择题 下列电池工作时,O2在正极放电的是

参考答案:B
本题解析:氢氧燃料电池,氧气在正极通入,氢气在负极通入,故答案选B,
考点:燃料电池
本题难度:简单
3、填空题 (6分)下图为氢氧燃料电池的示意图:
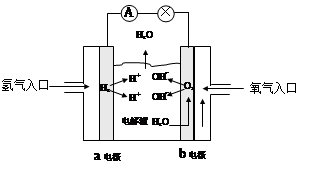
⑴若以稀硫酸为电解液,则a极为___?_极。
⑵若以KOH溶液作电解液,则b极上的电极反应式为_______________________,放电一段时间后电解液的pH将________(填“变大”、“变小”或“不变”)。
参考答案:(每空2分,共6分)?(1)负,(2)O2+2H2O+4e-=4OH-,变小
本题解析:(1)氢气在反应中失去电子,所以在负极通入,即a是负极。
(2)氧气得到电子,在正极通入,电极反应式为O2+2H2O+4e-=4OH-。由于在反应中产生水,所以氢氧化钾溶液的浓度降低,pH变小。
本题难度:简单
4、选择题 美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意如下图,下列说法正确的是
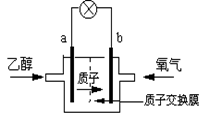
A.a极为电池的正极
B.电池工作时电子由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e=2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移