1、选择题 下列关于热化学反应的描述中正确的是
[? ]
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
参考答案:B
本题解析:
本题难度:一般
2、选择题 用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是
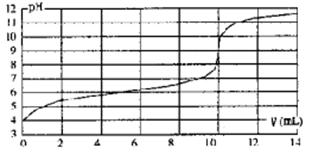
A.HA的浓度为l×10-4mol·L-1
B.实验时可选甲基橙作指示剂
C.V=10mL,酸碱恰好中和
D.pH=7时,溶液中c(Na+)>c(A-)
参考答案:C
本题解析:A、根据图像可知恰好反应时溶液的pH=9,溶液显碱性,这说明生成的盐水解,因此HA是弱酸。起始时HA溶液的pH=4,所以HA的浓度大于l×10-4mol·L-1,A不正确;B、反应终点时溶液显碱性,而甲基橙变色范围为3.1~4.4,所以不能选择甲基橙作指示剂,B不正确;C、根据图像可知曲线发生突变是消耗氢氧化钠溶液的体积是10ml,所以V=10mL,酸碱恰好中和,C正确;D、根据电荷守恒可知,pH=7时,即c(H+)=c(OH-),所以溶液中c(Na+)=c(A-),D不正确,答案选C。
本题难度:一般
3、选择题 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L。x与y的关系图所示,下列说法正确的是
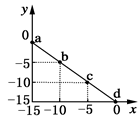
A.该温度高于25℃
B.图中a点溶液呈碱性
C.该温度下,0.01 mol·L-1的HCl溶液的pH=2
D.该温度下,0.01 mol·L-1的NaOH溶液的pH=12
参考答案:BC
本题解析:A、c(OH-)+c(H+)=10-15,而25°时c(OH-)+c(H+)=10-14,故该温度应低于25℃。
B、a点对应的c(H+)=10—15mol/L,c(OH-)=0mol/L,故为碱性。
C、0.01 mol·L-1的HCl溶液中c(H+)=10-2,根据pH=-㏒10(H+),得PH=2。
点评:此题考核了溶液PH和氢离子、氢氧根离子的关系,熟悉掌握PH的计算式,难度不大。
本题难度:一般
4、选择题 有人预言:H2是21世纪最理想的能源,其根据不正确的是(?)
A.生产H2的原料来源广阔
B.在等质量的可燃气体中,H2燃烧时放出的热量多
C.H2易液化,携带方便
D.燃烧时无污染
参考答案:C
本题解析:根据氢气的物理性质和化学性质及氢气作燃料的优点,H2难液化,携带不方便。
本题难度:简单
5、填空题 (14分)已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH=?。若酸碱按体积比为1:10混合后溶液显中性,则a+b=?。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为?mol·L-1,B溶液中水电离出的氢离子浓度为?。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA?VB,混合后溶液中的离子浓度关系为c(Na+)?c(CH3COO-) (填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,其水解反应的离子方程式为?。
参考答案:(1)7? 13?(2)10―10? 10―12 ?(3)<?=
本题解析:这题考察的是pH值计算及电解质溶液,要知道弱电解质与强电解质之间的区别—存在电离平衡。
(1)?可以借助数学方法(举例法)来解决这一小题。设酸的浓度为0.1mol/L,碱的浓度为0.1 mol/L(a+b=14),二者等体积混合,溶液必然是中性,pH=7;混合后溶液中性,H+物质的量等于OH-的物质的量,酸碱按体积比为1:10,所以浓度之比为10:1,设酸的浓度为0.1mol/L,则碱的浓度为0.01 mol/L,所以a+b=13.
(2)?需知道:水电离出的氢离子浓度=氢氧根离子浓度和C(H+)·C(OH-)=10-14对于酸:水电离出来的C(H+)=C(OH-)=10-14/10-4=10―10;对于碱:水电离出来的C(H+)= 10―12 ?(全部来自于水的电离)。
(3)?我们可以这么想:如果等体积混合,溶液应该显酸性(因为醋酸是弱电解质,会不断电离出氢离子),所以VA < VB,根据电荷守恒,由于C(H+)=C(OH-),所以c(Na+) =??c(CH3COO-)
(4)?根据题意判断,是强酸弱碱,所以M+ + H20 ="=" MOH + H+
本题难度:一般