1、选择题 下列各组中属于同位素的是( )
A.40K与40Ca
B.35Cl2和37Cl2
C.D与T
D.金刚石与石墨
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列关于物质性质变化的比较,不正确的是( )
A.原子半径:Na>S>O
B.酸性强弱:HIO4>HBrO4>HClO4
C.碱性强弱:KOH>NaOH>LiOH
D.金属性强弱:Na>Mg>Al
参考答案:A.同周期元素从左到右原子半径逐渐减小,则Na>S,原子核外电子层数越多,半径越大,O的原子核外有2个电子层,半径最小,则原子半径:Na>S>O,故A不选;
B.非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,则有酸性强弱:HIO4>HBrO4>HClO4,故B选;
C.金属性:K>Na>Li,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则有碱性强弱:KOH>NaOH>LiOH,故C不选;
D.同周期元素从左到右金属性逐渐减弱,则有金属性强弱:Na>Mg>Al,故D不选.
故选B.
本题解析:
本题难度:简单
3、填空题 下表是元素周期表的一部分,请回答有关问题:
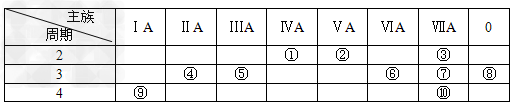
(1)?表中化学性质最不活泼的元素,其原子结构示意图为________________。
(2)?表中能形成两性氢氧化物的元素是________(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式________________________________________。
(3)?①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为___________________________(用化学式表示)。
(4)?③元素与⑩元素两者核电荷数之差是_____________________________。
(5)?请写出②的氢化物发生催化氧化的化学方程式___________________________________。
(6)?请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式___________________________________。
参考答案:(1)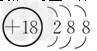 ?
?
(2)铝?;?2Al+2KOH+2H2O===2KAlO2+3H2?↑
(3)?KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4?
(4)?26?
(5)4NH3+5O2 4NO+6H2O
4NO+6H2O
(6)?Al(OH)3+3H+===?Al3++3H2O
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的名称.A_________,D___________, E__________。
(2)A、B、C、D、E、F所形成的简单离子的半径由大到小的顺序是_________________。
(3)D、E、F对应的气态氢化物的稳定性顺序为_____________。
(4)B的单质在F的单质中反应的现象是___________,化学方程式为_________________。
(5)A、C两种元素最高价氧化物对应水化物反应的离子方程式为__________________。
参考答案:(1)钠;硅;磷
(2)Si4->p3->Cl->Na+>Mg2+>Al3+
(3)HCl>PH3>SiH4
(4)产生白色的烟;Mg+Cl2 MgCl2
MgCl2
(5)OH-+Al(OH)3=AlO2-+2H2O
本题解析:
本题难度:一般
5、选择题 下列对于乙烯(CH2=CH2)分子结构的描述中正确的是
A.有6个σ键、0个π键
B.3个sp3杂化轨道形成σ键、1个sp3杂化轨道形成π键
C.C-H之间是s轨道与sp2轨道形成的σ键,C与C之间是未参加杂化的2p轨道形成的σ键和π键
D.C与C之间是sp2杂化轨道形成的一个σ键和未参加杂化的2p轨道形成的π键
参考答案:D
本题解析:试题分析:单键都是σ键,双键或三键中含有π键,据此可知,乙烯分子中含有5个σ键、1个π键,A错误;乙烯是平面型结构,碳原子是sp2杂化,杂化轨道只能形成σ键,所以选项BC都是错误,D正确,答案选D。
考点:考查乙烯的分子结构特点
点评:该题是基础性试题的考查,主要是考查学生对乙烯分子结构的熟悉了解程度,特别是杂化轨道类型的掌握情况,有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:一般