1、选择题 下列各组中属于同位素的是( )
A.40K与40Ca
B.35Cl2和37Cl2
C.D与T
D.金刚石与石墨
2、选择题 下列关于物质性质变化的比较,不正确的是( )
A.原子半径:Na>S>O
B.酸性强弱:HIO4>HBrO4>HClO4
C.碱性强弱:KOH>NaOH>LiOH
D.金属性强弱:Na>Mg>Al
3、填空题 下表是元素周期表的一部分,请回答有关问题:
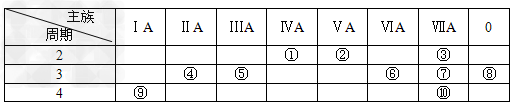
(1)?表中化学性质最不活泼的元素,其原子结构示意图为________________。
(2)?表中能形成两性氢氧化物的元素是________(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式________________________________________。
(3)?①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为___________________________(用化学式表示)。
(4)?③元素与⑩元素两者核电荷数之差是_____________________________。
(5)?请写出②的氢化物发生催化氧化的化学方程式___________________________________。
(6)?请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式___________________________________。
4、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的名称.A_________,D___________, E__________。
(2)A、B、C、D、E、F所形成的简单离子的半径由大到小的顺序是_________________。
(3)D、E、F对应的气态氢化物的稳定性顺序为_____________。
(4)B的单质在F的单质中反应的现象是___________,化学方程式为_________________。
(5)A、C两种元素最高价氧化物对应水化物反应的离子方程式为__________________。
5、选择题 下列对于乙烯(CH2=CH2)分子结构的描述中正确的是
A.有6个σ键、0个π键
B.3个sp3杂化轨道形成σ键、1个sp3杂化轨道形成π键
C.C-H之间是s轨道与sp2轨道形成的σ键,C与C之间是未参加杂化的2p轨道形成的σ键和π键
D.C与C之间是sp2杂化轨道形成的一个σ键和未参加杂化的2p轨道形成的π键