1、选择题 将1.12g铁粉加入25mL2mol/L的FeCl3溶液中,充分反应后,其结果是(? )
A.铁恰好将Fe3+全部还原
B.往反应后溶液中滴入KSCN溶液,不显红色
C.溶液变为浅绿色
D.Fe2+和Fe3+物质的量之比为6:1
参考答案:D
本题解析:将1.12g铁粉加入到25mL 2mol?L-1的氯化铁溶液中,铁粉的物质的量n=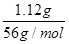 ?=0.02mol。氯化铁的物质的量n=C×V=2mol?L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁。所以氯化铁剩余0.01mol,生成的Fe2+的物质的量为0.06mol。A选项错误。B选项错误,由于溶液中有三节铁离子剩余,故显红色。C选项,由于有三价铁离子剩余,故溶液应为浅绿与红棕的混合色。错误。D选项正确。
?=0.02mol。氯化铁的物质的量n=C×V=2mol?L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁。所以氯化铁剩余0.01mol,生成的Fe2+的物质的量为0.06mol。A选项错误。B选项错误,由于溶液中有三节铁离子剩余,故显红色。C选项,由于有三价铁离子剩余,故溶液应为浅绿与红棕的混合色。错误。D选项正确。
本题难度:一般
2、计算题 40克铁粉投入到500克稀HNO3中,若两种物质恰好完全溶解(还原产物为NO),求此稀HNO3的质量分数和生成气体在标态下的体积?
参考答案:(1)生成物全部是Fe(NO3)3时。
设HNO3的质量为x,生成NO的体积为V1
Fe+4HNO3====Fe(NO3)3+NO↑+2H2O
56g?4×63g?22.4L
40g?x? V1
解得:x=180g。
V1=16L。
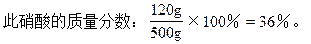
(2)当生成物全部是Fe(NO3)2时
设HNO3的质量为y,生成NO的体积为V2
3Fe? +? 8HNO3====3Fe(NO3)2+2NO↑+4H2O
3×56g?8×63g?2×22.4L
40g? y? V2
解得:y=120g,V2=10.67L,
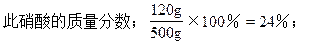
(3)当生成物是Fe(NO3)2和Fe(NO3)3时硝酸的质量分数在24%~36%之间,
生成NO气体的体积在10.67L~16L之间。
∴此硝酸的质量分数是:24%≤HNO3%≤36%,
生成NO的体积是:10.67L≤VNO≤16L。
本题解析:恰好完全溶解有3种情况:(1)生成物全部是Fe(NO3)3,(2)生成物全部是Fe(NO3)2,(3)生成物是Fe(NO3)3和Fe(NO3)2的混合物。
本题难度:一般
3、推断题 以下一些氧化物和单质之间可发生如下图所示的反应:
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
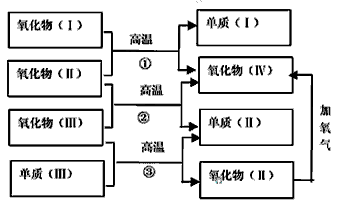
(1)氧化物(Ⅰ)的化学式(分子式)是________。氧化物(Ⅱ)的化学式(分子式)是________。
(2)反应①的化学方程式是__________________。反应②的化学方程式是_______________________。反应③的化学方程式是__________________。
参考答案:(1)?Fe2O3 ;CO?
(2)① Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
② CO+H2O CO2+H2
CO2+H2
③ C+H2O CO+H2 (如写可逆号,同样给分)
CO+H2 (如写可逆号,同样给分)
本题解析:
本题难度:一般
4、选择题 为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中? (? )
A.通入氯气
B.加入Zn
C.加入Fe
D.加入Cu
参考答案:C
本题解析:除杂的基本原则是不增不减,易分离易复原。故最好加入Fe,反应后过滤,得到只有Fe2+。
本题难度:一般
5、填空题 若把Fe3O4看成“混合氧化物”时可以写成FeO?Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4可以分别写作?
和?。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将HCl氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式?,
?。
参考答案:(2分×4=8分)
2PbO·PbO2和Pb2PbO4;Fe3O4+8HCl = FeCl2+2 FeCl3+4H2O
Pb3O4+8HCl =" 3" PbCl2+Cl2↑+4H2O
本题解析:略
本题难度:简单