1、实验题 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
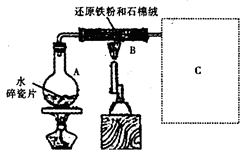
(1)装置B中发生反应的化学方程式是?。
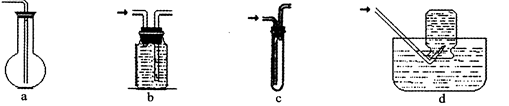
(2)虚线框图C的气体收集装置是下图中的??(选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:?
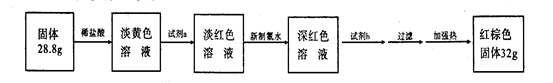
试剂a的化学式是?,试剂b的化学式是?;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)?。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
?;为了对所提出的假设2进行验证,实验方案是?
??。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为?。
参考答案:
(1)3Fe + 4H2O 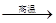 ?Fe3O4 + 4H2↑ (1分)
?Fe3O4 + 4H2↑ (1分)
(2)bd?(2分)
(3)KSCN ,NaOH;2Fe2++Cl2→2Fe3++2Cl-?(1分1格,共3分)
(4)SCN-被过量的氯水氧化;(2分)
取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。(2分)
(5)77.8% (2分)
本题解析:(2)氢气难溶于水,可用排水法收集。选bd。
(3)因为铁和水反应生成Fe3O4,Fe3O4,+8HCl=2FeCl3+FeCl2+4 H2O 。淡黄色溶液含少量Fe3+,加a:KSCN,Fe3++3SCN- =Fe(SCN)3 ?少量淡红色。加新制的氯水,把FeCl2氧化变成FeCl3和KSCN生成
Fe(SCN)3,再加NaOH,能生成Fe(OH)3 ?。加热Fe(OH)3变成红棕色的Fe2O3
(4)“SCN-被过量的氯水氧化”,为证明此假设,需加过量的KSCN溶液,看是否变红。
(5)解设原铁元素的质量为x
2Fe------- Fe2O3
2*56? 160
x? 32? x=22.4
Fe%=22.4*100%/28.8=77.8%
本题难度:困难
2、选择题 将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是
A. HNO3
B.饱和澄清石灰水
C.C2H5OH
D. H2SO4
参考答案:.C
本题解析:在反应过程中,铜丝做催化剂。
本题难度:简单
3、选择题 某稀溶液中均含有1 mol的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉,溶液中Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐标/mol)之间的关系为( )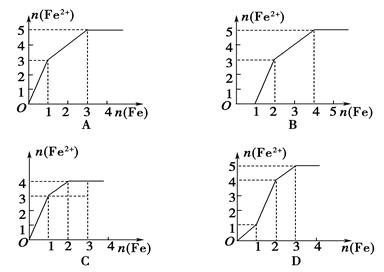
参考答案:A
本题解析:随着铁的加入,依次发生反应为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+、Fe+2H+=H2↑+Fe2+,结合所给物质的量,可得答案为A
本题难度:一般
4、推断题 以下一些氧化物和单质之间可发生如图所示的反应: 其中,氧化物( I)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ) 在反应条件下都是气体。

(1)氧化物(I)的化学式(分子式)是____, 氧化物(Ⅱ)的化学式(分子式)是____。
(2)反应①的化学方程式是___, 反应②的化学方程式是_____, 反应③的化学方程式是____。
参考答案:(1) Fe2O3 ;CO
(2) Fe2O3+3CO 2Fe +3CO2 ;CO +H2O
2Fe +3CO2 ;CO +H2O CO2+H2 ;H2O+C
CO2+H2 ;H2O+C H2+CO
H2+CO
本题解析:
本题难度:一般
5、实验题 (12分)图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 ? 。A中反应的离子方程式是 ?。
(2)实验开始时先应将活塞D (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式 。
参考答案:(1)铁屑,Fe+2H+=Fe2++H2↑?(2)打开,H2
(3)关闭活塞D,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:(1)A装置是制取FeSO4的装置,所以先加入的试剂是铁屑,发生的离子反应为Fe+2H+=Fe2++H2↑。
(2)实验开始时,应该先排除装置中的空气,所以应该先把活塞D打开,让产生的氢气充满整个装置。
(3)当整个装置充满氢气后,关闭活塞D,由于A中继续产生气体会将生成的FeSO4压入到B装置中,因此反应产生了Fe(OH)2。
(4)空气进入会将Fe(OH)2氧化,其反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
点评:本题的关键是要分析出活塞D的用处。
本题难度:一般