1、选择题 SO2气体分别通入下列溶液中,不反应的是
A.NaOH溶液
B.酸性KMnO4溶液
C.溴水
D.CuSO4溶液
参考答案:D
本题解析:SO2是酸性氧化物,所以能和碱反应;SO2具有还原性,所以能和氧化剂溴水、酸性KMnO4溶液反应;而亚硫酸的酸性弱于硫酸,所以不能和硫酸铜溶液反应,不能用弱酸制强酸.
本题难度:一般
2、选择题 在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,被还原的硝酸与未被还原硝酸的分子个数比为
A.2:1
B.1:4
C.3:1
D.1:3
参考答案:D
本题解析:分析:该反应中,铜失电子作还原剂,部分硝酸作氧化剂,根据反应方程式中元素化合价变化确定参加氧化还原反应的硝酸和未参加氧化还原反应的硝酸并结合N=nNA来解答.
解答:反应中N元素化合价降低,HNO3为氧化剂,Cu元素化合价升高,被氧化,根据方程式可判断,当8molHNO3参加反应时,有2mol被还原,表现为氧化性,6molHNO3表现为酸性,被还原的HNO3与未被还原的HNO3物质的量之比是1:3,根据N=nNA知被还原的硝酸与未被还原硝酸的分子个数比为1:3,
故选D.
点评:本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析.
本题难度:简单
3、选择题 将2a?L Al2(SO4)3和(NH4)2SO4的混合物溶液分为两等份,其中一份加入b?mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c?mol NH3气,则原混合溶液中的Al3+离子浓度(mol/L)为
A.
B.
C.
D.
参考答案:C
本题解析:分析:根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH- NH3↑+H2O计算NH4+的物质的量,再根据c=
NH3↑+H2O计算NH4+的物质的量,再根据c=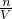 计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
解答:向aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol?bmol
c(SO42-)=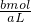 =
=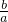 mol/L,
mol/L,
向aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH- NH3↑+H2O
NH3↑+H2O
cmol? ?cmol
c(NH4+)= =
= mol/L,
mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+ mol/L×1=
mol/L×1=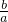 mol/L×2,
mol/L×2,
解得x= mol/L,
mol/L,
故选C.
点评:本题考查混合物的有关计算、根据离子方程的计算、物质的量浓度的计算等,清楚发生的离子反应及溶液不显电性是解答本题的关键,熟悉物质的量浓度的计算公式.
本题难度:简单
4、选择题 有物质的量相等的短周期金属元素单质A和B,在A中加入足量盐酸,在B中加入足量稀硫酸,反应完全后,生成氢气的体积为V1和V2,且V1≠V2,若要确定生成物中A和B的化合价,至少还需要的数据是
A.V1:V2的值
B.V1和V2的值
C.A和B的物质的量
D.盐酸和稀硫酸的浓度
参考答案:AC
本题解析:分析:根据结论:气体的体积比等于物质的量比,以及活泼金属与酸反应置换氢气公式:n(氢气)= =
= ×金属的物质的量×金属元素的化合价.
×金属的物质的量×金属元素的化合价.
解答:气体的体积比等于物质的量比,所以A答案和C答案的结果是一样的,活泼金属与酸反应置换氢气有个经验公式:n(氢气)= ×金属的物质的量×金属元素的化合价,要确定化合价则必须知道生成氢气的体积或金属的物质的量中的一个,又化合价为正整数值,则由两个反应中生成氢气的体积比值可确定金属的化合价.
×金属的物质的量×金属元素的化合价,要确定化合价则必须知道生成氢气的体积或金属的物质的量中的一个,又化合价为正整数值,则由两个反应中生成氢气的体积比值可确定金属的化合价.
故选AC.
点评:本题考查学生金属和酸反应的特点规律,要求学生善于根据所学知识来总结规律,学以致用.
本题难度:简单
5、选择题 下列物质中,分别加入少量溴水,振荡后静置,溶液无色的是
A.NaOH溶液
B.NaCl
C.KI溶液
D.Zn粉
参考答案:AD
本题解析:正确答案:ADA、2NaOH+Br2=NaBr+NaBrO+H2O, NaBr和NaBrO均呈无色B、不反应;C、2KI+Br2=I2+2KBr,碘水呈黄色D、Zn+Br2=ZnBr2,溶液呈无色。
本题难度:一般