1、选择题 根据下图,下列判断中不正确的是(?)
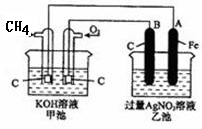
A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH-
B.反应一段时间后,甲池中溶液的pH降低
C.乙池中电极B上发生还原反应
D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下)
参考答案:C
本题解析:根据装置图可知,甲池是甲烷燃料电池,乙池是电解池。原电池中负极失去电子,正极得到电子,所以氧气在正极通入,甲烷在负极通入。则B电极的碳棒是阳极,A电极的铁是阴极。甲池中电解质是氢氧化钾溶液,则通入O2的电极的电极反应式为:O2 + 2H2O + 4e-=4OH-,A正确;甲池中的总反应式是CH4+2KOH+2O2=K2CO3+3H2O,所以反应一段时间后,甲池中溶液的pH降低,选项B正确;电极B是阳极,溶液中的OH-失去电子,发生氧化反应,C不正确;乙池中A电极是溶液中的银离子放电,电极反应式是Ag++e-=Ag。析出银的质量是10.80g,物质的量是0.1mol,转移0.1mol电子,则根据电子的得失守恒可知,消耗甲烷的物质的量是0.1mol÷8=0.0125mol,氧气的物质的量是0.1mol÷4=0.025mol,在标准状况下的体积是(0.025mol+0.0125mol)×22.4L/mol=0.84L=840ml,D正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确原电池和电解池的工作原理,特别是电极名称、电极反应式、电极产物的判断等,有利于培养学生的逻辑推理能力,提升学生的学科素养。有关电化学的计算,一般根据电子得失守恒进行。
本题难度:一般
2、填空题 某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
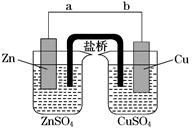
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
参考答案:(1)由a到b(或a→b)
(2)Zn-2e-=Zn2+
(3)1.204×1022
(4)B
本题解析:在该原电池中负极为Zn,电极反应为Zn-2e-=Zn2+,正极为铜,电极反应为Cu2++2e-=Cu,当铜电极增加0.64 g时,转移电子(由a到b)为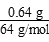 ×6.02×1023 mol-1×2=1.204×1022。盐桥中K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。
×6.02×1023 mol-1×2=1.204×1022。盐桥中K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。
本题难度:一般
3、选择题 通过NOx传感器可监测NOx的含量,其工作原理示意图如下:下列说法正确的是 (?)

A.NiO电极发生还原反应
B.Pt电极是电池的负极
C.NiO 电极的电极反应式:NO—2e—+O2—=NO2
D.该电池在标准状况下,若Pt电极消耗2.24L O2,NiO电极电极产生2.24LNO2气体
参考答案:C
本题解析:A、NiO 电极NO失去电子生成NO2,为负极,发生氧化反应,错误;B、Pt电极氧气得到电子生成O2-,为正极,错误;C、正确;D、NiO电极电极产生4.48LNO2气体,错误。
本题难度:一般
4、选择题 (15分) 现有A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。已知A与E、D与F分别同主族, E、F、G同周期;A、C的最外层电子数之和与D的最外层电子数相等,A与D形成的化合物常温下为液态,A分别与F、G形成的气体分子电子总数相等、B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具。
请回答下列问题:
(1)元素C在周期表中的位置是_______________
元素E的原子结构示意图为
(2)C的气态氢化物的水化物与其最高价氧化物的水化物可发生反应,离子方程式为:
(3)在一定条件下,A、D的单质和A、D、E形成的离子化合物的水溶液可构成电池,该电池负极的电极反应式为 , 该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(4)化合物C2A4(g) 是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示) 。
参考答案:(15分)
(1)第二周期VA; 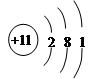 (4分)
(4分)
(2)NH3.H2O+H+=NH4++H2O (3分)
(3)H2+2OH--2e-=2H2O ( 3分) 减小 (2分)
(4)N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1 (3分)
本题解析:B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具,则B为C元素;A与D形成的化合物常温下为液态,则A为H元素、D为O元素;根据原子序数依次增大,C为N元素;已知A与E、D与F分别同主族,这七种元素都位于短周期,A分别与F、G形成的气体分子电子总数相等,所以E为Na元素、F为S元素、G为Cl元素。
(1)C为N元素,在周期表中的位置是:第二周期VA族; Na原子根据示意图: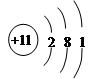
(2)C的气态氢化物的水化物为NH3?H2O,最高价氧化物的水化物为HNO3,发生酸碱中和反应,离子方程式为:NH3.H2O+H+=NH4++H2O
(3)A、D的单质分别为H2、O2,A、D、E形成的离子化合物为NaOH,形成燃料电池,负极发生H2失去电子的反应,电极方程式为:H2+2OH--2e-=2H2O;电池反应为2H2+O2=2H2O,生成了H2O,使NaOH溶液的浓度减小,所以电解质溶液的pH将减小。
(4)化合物C2A4为N2H4,完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,则生成物是N2和H2O,0.25 mol N2H4完全燃烧放出热量为133.5 kJ,则1mol N2H4完全燃烧放出热量为534 kJ,所以热化学方程式为:N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1
考点:本题考查元素的推断、原子结构示意图、物质的性质、原电池原理、热化学方程式的书写。
本题难度:一般
5、简答题 (12分)
(1)在室温下测得0.1mol·L-1氨水PH=11,则该温度下氨水的电离度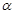 =__________
=__________
(2)25℃时在0.1mol·L-1的H2A水溶液中,用氢氧化钠来调节溶液的pH,得到其中含H2A、HA-、A2-三种微粒的溶液。
①当溶液的pH=7时,c(Na+)=__________(填微粒间量的关系)
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时溶液为__________溶液(填物质)。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和液态水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是__________。
(4)甲醇—空气燃料电池是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH+3O2=2CO2+4H2O。其工作原理示意图如下(其中a、b、c、d四个出入口表示通入或排出的物质)。
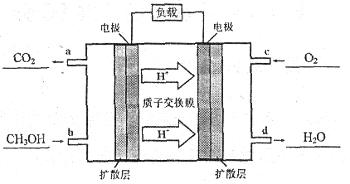
则负极的电极反应式为__________;正极的电极反应式为__________
参考答案:(1)1.0%?(2)①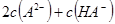 ?②
?②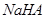
(3)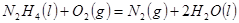 △
△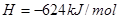
(4)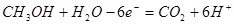 ?
?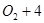
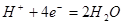
本题解析:(1)0.1mol·L-1氨水PH=11,则该溶液中OH-浓度是0.001mol/L,所以其电离度是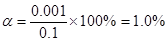 。
。
(2)①根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)可知,当pH=7时,c(Na+)=c(HA-)+2c(A2-)。
②当c(Na+)=c(A2-)+c(HA-)+c(H2A)时,符合物料守恒,所以溶质是NaHA。
(3)32.0gN2H4是1mol,放热是624kJ,所以热化学方程式为
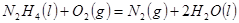 △
△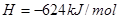 。
。
(4)原电池中负极失去电子,正极导电电子。因此甲醇在负极通入,氧气在正极通入,所以根据总反应式可知,负极和正极的电极反应式分别是
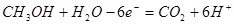 、
、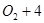
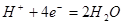 。
。
本题难度:一般