1、填空题 (14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g) ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间 (已知磷酸的各级电离常数为:K1 = 7.1×10?3 K2 = 6.3×10?8 K3 =4.2×10?13 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
参考答案:⑴a、2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO (2分)b、生成CaSiO3放出一定的能量使反应热△H降低;CaSiO3的熔点比SiO2低,成为熔融态浮在表面,对白磷有保护作用 (2分)
6CaSiO3+P4+10CO (2分)b、生成CaSiO3放出一定的能量使反应热△H降低;CaSiO3的熔点比SiO2低,成为熔融态浮在表面,对白磷有保护作用 (2分)
⑵PH3(2分)⑶2.1~7.2 (4分) 3Ca2++2HPO4-=Ca3(PO4 )2↓+2H+(2分) ⑷3mol(2分)
本题解析:(1)a、白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到:①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1,②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1,③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1,这说明反应中还有硅酸钙和CO生成,因此由磷酸钙矿制取白磷总的反应方程式为2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO。
6CaSiO3+P4+10CO。
b、由于白磷易被氧化,生成CaSiO3放出一定的能量,而CaSiO3的熔点比SiO2低,是硅酸钙成为熔融态浮在表面,对白磷有保护作用。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体,则根据氧化还原反应电子得失守恒可知,该气体中P元素的化合价要低于0价,因此该气体是PH3。
(3)如果磷酸只发生一级电离,则根据电离常数可知溶液的pH=3—0.9=2.1。根据二级电离常数可知溶液的pH=8—0.8=7.2,所以工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在2.1~7.2 之间。Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,则发生反应3Ca2++2HPO4-=Ca3(PO4 )2↓+2H+,因此溶液则显酸性。
(4)根据方程式可知被氧化的P化合价从0价升高到+5价,失去5个电子,即1mol白磷失去20mol电子。硫酸铜中铜元素的化合价从+2价降低到+1价,得到1个电子。因此根据电子得失守恒可知60molCuSO4能氧化白磷的物质的量是60mol÷20=3mol。
考点:考查白磷制备、性质、氧化还原反应、离子反应以及电离常数应用等
本题难度:困难
2、选择题 氨水中存在下列的电离平衡:NH3·H2O NH
NH +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
A.NaOH固体
B.NH4Cl固体
C.H2SO4
D.H2O
参考答案:A
本题解析:B项c(OH-)减少,C项c(OH-)减小,D项平衡向右移动且c(OH-)减小。
本题难度:一般
3、选择题 下列关于0.1 mol·L-1氨水的叙述正确的是
A.加入少量氯化钠溶液,平衡不移动
B.加入少量NaOH固体,平衡正向移动
C.通入少量氯化氢气体,平衡正向移动
D.加入少量MgSO4固体,抑制NH3·H2O电离
参考答案:C
本题解析:A、一水合氨是弱电解质,在氨水中存在电离平衡NH3·H2O NH4++OH-,加入少量氯化钠溶液,相当于是稀释,平衡向正反应方向移动,A不正确;B、加入少量NaOH固体,增大溶液中OH-的浓度,平衡逆向移动,B不正确;C、通入少量氯化氢气体,中和溶液中的OH-,降低溶液中的OH-的浓度,因此平衡正向移动,C正确;D、加入少量MgSO4固体,Mg2+结合OH-生成氢氧化镁沉淀,降低溶液中的OH-浓度,促进NH3·H2O电离,D不正确,答案选C。
NH4++OH-,加入少量氯化钠溶液,相当于是稀释,平衡向正反应方向移动,A不正确;B、加入少量NaOH固体,增大溶液中OH-的浓度,平衡逆向移动,B不正确;C、通入少量氯化氢气体,中和溶液中的OH-,降低溶液中的OH-的浓度,因此平衡正向移动,C正确;D、加入少量MgSO4固体,Mg2+结合OH-生成氢氧化镁沉淀,降低溶液中的OH-浓度,促进NH3·H2O电离,D不正确,答案选C。
本题难度:一般
4、选择题 冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是 ( )
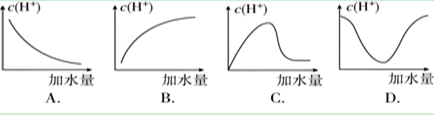
参考答案:C
本题解析:在浓醋酸中,“促进电离,增大氢离子浓度”起主要作用,氢离子浓度就增大,在稀醋酸中,“水的稀释减小氢离子浓度”起主要作用,氢离子浓度就减小,所以在整个稀释过程中,氢离子的物质的量一直是增大的,但氢离子浓度是先增大后减小,故选C。
考点:弱电解质的电离平衡
本题难度:一般
5、填空题 (10分)(1)下列物质能导电的是?,
属于电解质的是?,
属于非电解质的是?。
①水银②烧碱③大理石④氯化钠晶体⑤盐酸溶液⑥蔗糖
(2)按要求写出下列方程式:
①硫酸铝电离的电离方程式:?
②碳酸钙与盐酸反应的离子方程式:??
参考答案:(1)①⑤?②③④?⑥
(2)①Al2(SO4)3==2Al3++3SO42-
② CaCO3+2H+= Ca2++H2O+CO2↑41.7ml
本题解析:略
本题难度:简单