1、选择题 下列100mL液体中,其中导电能力最大的是
A.自来水
B.0.5mol/L盐酸
C.0.5mol/L硫酸
D.0.5mol/L氯化钠
2、选择题 室温下,下列有关两种溶液的说法不正确的是
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
3、选择题 下列化学实验事实及解释都正确的是
[? ]
A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力
B.升高温度会加快化学反应速率,其原因是增加了单位内活化分子的百分数
C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
D.向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明
?Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
4、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
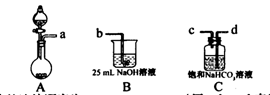
①各装置正确的连接顺序为?(用a、b、c、d表示)。
②检查整套装置气密性的方法是?。
③装置A中常用药品为?;装置C中化学药品的作用是?。
(2)写出步骤三中发生反应的离子方程式?。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法?。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
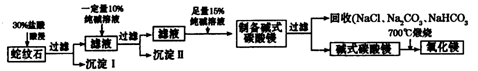
(1)过滤需要的玻璃仪器有?。
(2)沉淀Ⅱ的成分为?,请用离子方程式表示生成沉淀的过程?(写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为?。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____?,
5、填空题 (1)今有①盐酸 ②醋酸的两种溶液,在体积相同,物质的量浓度均为0.1 mol/L时,H+物质的量浓度:
①_______②(填“>”、“<”或“=”,下同),pH:①_______②;中和等量NaOH时消耗的体积:
①_______②;与足量的Zn反应生成H2的物质的量:①_______②。
(2)今有①醋酸 ②硫酸的两种溶液,在体积相同、pH均为2时,溶质物质的量浓度:①_______②;分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积:①_______②;加水稀释到pH均为3时,所加水的体积:①_______②。