1、选择题 常温下,有下列4种溶液,下列说法正确的是
①
| ②
| ③
| ④
|
0.1 mol·L-1
CH3COOH溶液
| pH=3 CH3COOH溶液
| 0.1 mol ·L-1
NaOH溶液
| pH=11 NaOH溶液
|
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
参考答案:D
本题解析:A.NaOH是强碱、CH3COOH是弱酸,它们都能使水的电离平衡H2O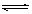 H++OH-左移,且前者使水的电离平衡左移的程度大于后者,导致水电离出的氢离子浓度更小,错误;B.根据稀释定律:c1·V1=c2·V2,则①稀释到原来的100倍后,醋酸的浓度变为0.001mol·L-1,但是醋酸是弱酸,即使稀释100倍也不能完全电离,则溶液中氢离子浓度小于0.001 mol·L-1,由于pH=-lgc(H+),则溶液pH>3,不可能与②相同,错误;C.若①与③等体积混合,根据n=c·V可知,NaOH和CH3COOH恰好完全中和,得到的CH3COONa是强碱弱酸盐,混合后溶液呈弱碱性,pH>7,若溶液pH=7,则醋酸一定过量,因此V(NaOH)<V(CH3COOH),错误;D.若①与③等体积混合,醋酸远远过量,NaOH严重不足,若溶液pH=7,V(CH3COOH)< V(NaOH),正确。
H++OH-左移,且前者使水的电离平衡左移的程度大于后者,导致水电离出的氢离子浓度更小,错误;B.根据稀释定律:c1·V1=c2·V2,则①稀释到原来的100倍后,醋酸的浓度变为0.001mol·L-1,但是醋酸是弱酸,即使稀释100倍也不能完全电离,则溶液中氢离子浓度小于0.001 mol·L-1,由于pH=-lgc(H+),则溶液pH>3,不可能与②相同,错误;C.若①与③等体积混合,根据n=c·V可知,NaOH和CH3COOH恰好完全中和,得到的CH3COONa是强碱弱酸盐,混合后溶液呈弱碱性,pH>7,若溶液pH=7,则醋酸一定过量,因此V(NaOH)<V(CH3COOH),错误;D.若①与③等体积混合,醋酸远远过量,NaOH严重不足,若溶液pH=7,V(CH3COOH)< V(NaOH),正确。
考点:考查弱电解质在水溶液中的电离平衡。
本题难度:一般
2、选择题 常温时,下列叙述正确的是
A.pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c )
B.pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C.AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D.1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
参考答案:B
本题解析:A、pH=9的NH4Cl与NH3·H2O混合溶液中NH3·H2O的电离程度大于NH4Cl的水解程度,所以c(Cl-)<c(NH4+),错误;B、pH=2.5的可乐中c(H+)=1×10-2.5mol/L,pH=3.5的柠檬水中c(H+)=1×10-3.5mol/L,前者是后者的10倍,正确;C、0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的氯离子的浓度不同,影响氯化银的溶解平衡,导致AgCl的溶解度不同,错误;D、Kw是温度常数,温度不变,Kw不变,错误,答案选B。w的判断,同一物质在不同溶剂中的溶解度的判断
本题难度:一般
3、选择题 对滴有酚酞试液的下列溶液,操作后颜色变深的是? ( )
A.AlCl3溶液中再溶入AlCl3
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.醋酸溶液加热
参考答案:B
本题解析:A项,氯化铝溶液中加入氯化铝,铝离子的水解平衡向右移动,溶液酸性增加,溶液颜色不会变深;B项,醋酸钠水解使溶液显碱性,加热可促进水解,使溶液碱性增强,溶液颜色变深;C项,氨水中加入少量氯化铵固体,氨水的电离平衡左移,使氨水的碱性减弱;D项,醋酸溶液加热可促进醋酸的电离,使溶液酸性增强。
本题难度:一般
4、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验
编号
| HA的物质的量浓度(mol·L-1)
| NaOH的物质的量浓度(mol·L-1)
| 混合后溶液的pH
|
甲
| 0.1
| 0.1
| pH=a
|
乙
| 0.12
| 0.1
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
|
?
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
?。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是?。
A.前者大?B.后者大? C.二者相等 ?D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是?。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=??mol/L。
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是?。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
参考答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-4-10-10
(5)A、C
本题解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐的pH,a=7为强酸,a>7为弱酸;
(2)根据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-);
(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+);
(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4-10-10;
(5)注意题干中的电离方程式,判断A项为B元素的物料守恒,C项为溶液中的质子守恒。
本题难度:一般
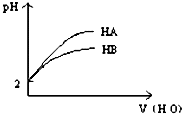
5、选择题 pH=2的两弱酸HA、HB加水稀释后,溶液pH随加水量的变化曲线如图所示.则下列叙述正确的是( )
A.电离平衡常数HA>HB
B.等体积等pH的HA和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积等pH的HA和HB与等质量的Zn反应,HA反应速率大
D.若有等浓度的NaA、NaB,则碱性NaA>NaB