1、填空题 (15分)研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;
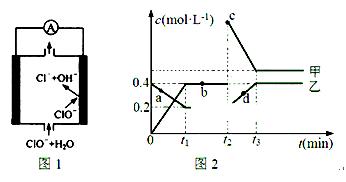
(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
参考答案:(1)(1)①2MgSO4 + CO  2MgO + SO2 + CO2 + SO3 (2分)
2MgO + SO2 + CO2 + SO3 (2分)
②ClO- + 2e- + H2O = Cl- + 2OH-(2分)
(2)①NO2(2分) ②b (2分) < (2分) ③增大NO2浓度(合理均可,2分)
(3)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H = -752.1kJ·mol-1(3分)
本题解析:(1)①750℃时,测得气体中含等物质的量的SO2和SO3,则根据原子守恒可知反应中还有氧化镁和CO2生成,因此此时反应的化学方程式是2MgSO4 + CO  2MgO + SO2 + CO2 + SO3 。
2MgO + SO2 + CO2 + SO3 。
②镁是活泼得金属,镁作负极,失去电子。次氯酸根得到电子,在正极放电,因此该电池的正极反应式为ClO- + 2e- + H2O = Cl- + 2OH-;
(2)①根据图像可知,甲与乙在相同时间内如果甲增加0.4mol/L,乙减少0.4mol/L—0.2mol/L=0.2mol/L,所以甲是NO2,乙是N2O4。
②a、c、d三点中物质得浓度均是变化的,因此一定不是平衡状态。B点物质的浓度不变,说明反应达到平衡状态,所以图中a、b、四点中,表示反应处于平衡状态的是b。t1~t2时间内反应处于平衡状态,则根据方程式N2O4 2NO2可知v正(乙)<v逆(甲)。
2NO2可知v正(乙)<v逆(甲)。
③反应进行到t2时刻,NO2浓度瞬间增大,N2O4浓度逐渐增大,所以改变的条件可能是增大NO2浓度。
(3)已知:①2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1,②2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1,则根据盖斯定律可知①—②即得到用H2催化还原NO消除污染的热化学方程式为2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H = -752.1kJ·mol-1。
考点:考查原电池、外界条件对平衡状态的影响、平衡状态判断以及盖斯定律的应用
本题难度:困难
2、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应为(?)
A.2H++2e—→H2↑
B.Fe2++2e—→Fe
C.2H2O+O2+4e—→4OH—
D.Fe3++e—→Fe2+
参考答案:C
本题解析:钢铁发生吸氧腐蚀时,正极上发生的电极反应是2H2O+O2+4e—→4OH— ,B项是负极的电极反应,故答案选C。
点评:考查原电池原理,属于基础题,解题的关键是要区分正负极发生的电极反应。
本题难度:简单
3、选择题 下列说法中正确的是(?)
A.在原电池中,物质在负极发生氧化反应
B.在原电池中,电子由正极流向负极
C.在电解池中,物质在阴极发生氧化反应
D.在电解池中,与电源正极相连的电极是阴极
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,所以选项A正确,其余选项都是错误的,答案选A。
点评:原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
本题难度:一般
4、填空题 【实验目的】利用所学知识,设计电池装置。
【实验用品】电极:镁条、铜片、铁片等。
【电解质】果汁(橙汁、苹果汁、柠檬汁等)。
【其他】导线、金属夹、发光二极管、500 mL烧杯。
【实验方案】①Cu—Mg原电池,电解质溶液为橙汁;
②Cu—Fe原电池,电解质溶液为苹果汁;
③Fe—Mg原电池,电解质溶液为柠檬汁。

【实验操作】用导线分别将三种方案中的金属片连接到金属夹上,分别将金属片两两插入到盛有果汁的三个500 mL的烧杯中,用发光二极管两端分别接触三种方案中金属活动性不同的金属夹。观察现象,连接方式如图所示。
【实验现象】三种方案中发光二极管均发光。
【实验结论】原电池把化学能转变为电能。
回答问题:
(1)连接装置时活泼金属接二极管的________极上,较不活泼金属接二极管的________极上。
(2)在方案①②中铜作电极情况__________________________。
(3)在方案①③中镁作电极情况__________________________。
(4)在方案②③中铁作电极情况__________________________。
(5)在方案③中负极反应为______,正极反应为________,总方程式为__________________________________________________________。
参考答案:(1)负 正 (2)Cu均作正极 (3)镁均作负极
(4)方案②中铁作负极,方案③中铁作正极
(5)Mg-2e-=Mg2+ 2H++2e-=H2↑
Mg+2H+=Mg2++H2↑
本题解析:在原电池中较活泼金属作负极(连接二极管的负极),较不活泼金属作正极(连接二极管的正极)。因金属活动性:Mg>Fe>Cu,故方案①②中Cu均作正极,①③中Mg均作负极,方案②中铁作负极,方案③中铁作正极。在方案③中负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,总电池方程式为Mg+2H+=Mg2++H2↑。
本题难度:一般
5、选择题 下列装置烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是
[? ]
A.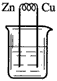
B.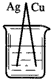
C.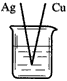
D.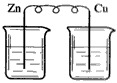
参考答案:A
本题解析:
本题难度:简单