1、填空题 (10分)(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。肼—空气燃料电池放电时,正极的电极反应式是 ;负极的电极反应式是 。
(3)如图是一个电化学过程示意图。假设使用肼—空气燃料电池作为本过程的电源,铜片质量变化128g,则肼—空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气的体积含量为20%)。
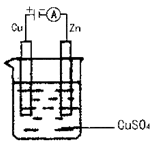
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式是 。
2、选择题 能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是?
[? ? ]
A.用铜片作阴、阳电极,电解氯化铜溶液
B.用铜片作阴、阳电极,电解硫酸钾溶液
C.铜锌合金在潮湿空气中发生电化学腐蚀
D.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
3、选择题 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池。如图,下列有关分析正确的是
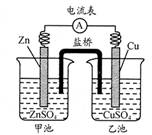
A.负极发生氧化反应:Cu—2e—=Cu2+
B.电池工作时,盐桥逐渐变蓝
C.向乙池中通入H2S后,电池反应停止
D.若将电极Cu改为石墨,电池电流强度发生变化
4、填空题 (10分)甲醇合成反应为:CO(g)+2H2(g) 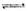 ?CH3OH(g)
?CH3OH(g)
工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g)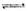 CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
(2)合成甲醇:①反应过程 中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。

实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
(表中数据单位:mol·L—1)
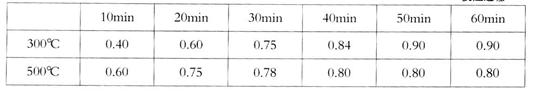 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系?产生的影响是__________(填字母)。
a.c(H2)减小? b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加? d.重新平衡时c(H2)/c(CH3OH)减小
5、选择题 对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法正确的是
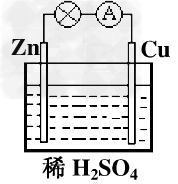
[? ]
①Zn是负极 ②电子由Zn经外电路流向Cu ③Zn?-2e-=Zn2+ ④H+在溶液中由Cu棒向Zn棒迁移
A.?①②?
B.?①②③?
C.?②③④?
D.?①②③④