1、选择题 用惰性电极电解一定浓度的CuSO4溶液一段时间后,加入0.1molCu2(OH)2CO3恰好使溶液恢复到原来的状态,则整个电解过程中转移电的子物质的量为( )
A.0.2mol
B.0.4mol
C.0.5mol
D.0.6mol
参考答案:电解硫酸铜时,初阶段:2CuSO4+2H2O?通电?.?2Cu↓+O2↑+2H2SO4,后阶段:2H2O?通电?.?2H2↑+O2↑,
如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了一个水(0.1molH2O),这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.4mol电子,第一阶段转移了0.2mol电子,所以总共转移电子0.6mol.
故选D.
本题解析:
本题难度:简单
2、选择题 下列关于电解质溶液的叙述正确的是
A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2
B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均降低
C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4
D.0.1 mol·L-1的硫酸铵溶液中,离子浓度大小顺序为: c(NH4+)>c(SO42-)>c(H+) >c(OH-)
参考答案:D
本题解析:A由于中和的盐酸和硫酸pH与体积都相同,所以溶液中的氢离子都相同,则消耗NaOH的物质的量之比是1∶1,故错
B、pH=13的氨水中含有H+? NH4+ OH-,由于溶液体积增大OH-浓度减小,但是溶液中由于H+和OH-乘积是定值,所以氢离子浓度增大
C.浓度均为0.1 mol·L-1的下列溶液,由于碳酸钠呈碱性,硫酸氢钠能电离出氢离子浓度大于铵根离子水解产生的氢离子浓度,所以硫酸氢钠的酸性最强,pH最小,pH由大到小排列顺序为:NaOH>Na2CO3>(NH4)2SO4> NaHSO4,
D.0.1 mol·L-1的硫酸铵(NH4)2SO4溶液中,溶液呈酸性,离子浓度大小顺序为: c(NH4+)>c(SO42-)>c(H+) >c(OH-),故对。
点评:本题主要考察了离子浓度大小的比较,掌握离子能否发生水解是解题的关键,
本题难度:一般
3、选择题 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12?mol电子,最多有1?mol?Cr2O72-被还原
参考答案:A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应为Fe-2e-═Fe2+,故A正确;
B.由反应式Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,处理过程中消耗氢离子,溶液的酸性减弱,溶液pH增大,故B错误;
C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生成,故C正确;
D.Fe-2e-=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e-~6Fe2+~Cr2O72-,故被还原的Cr2O72-的物质的量为1mol,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
[? ]
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子
参考答案:CD
本题解析:
本题难度:一般
5、填空题 25.(12分)发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g) ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g) ΔH =" +23.4" kJ·mol-1
NH3(g) ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
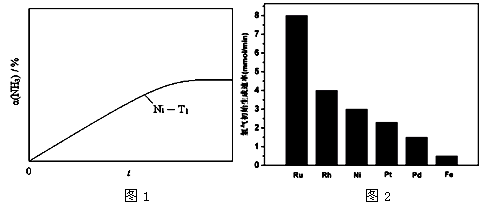
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
参考答案:(1) 高温
(2) -1172.4 kJ·mol-1
(3) ①Fe
② 见图曲线Ru-T1
③ 见图曲线 Ru-T2

(4) 2NH3 + 2e-= H2 + 2NH2- (或2NH4++2e-= H2 +2NH3)
本题解析:(1)高温有利于正反应的发生,可促进氨气的自发分解;(2)2NH3(g)  N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l)
N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l) NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
考点:热化学方程式及相关计算、电极方程式的书写
点评:本题较有难度,关键是要掌握热化学方程式的计算和电极方程式的书写。
本题难度:困难