|
高考化学知识点整理《电解池原理》在线测试(2019年最新版)(八)
2020-07-08 00:52:20
【 大 中 小】
|
1、选择题 串联电路中的四个电解池分别装有0.1 mol·L-1的下列溶液,用铂电极电解,连接直流电源一段时间后,溶液的pH变小的是
A.盐酸
B.NaCl
C.AgNO3
D.KNO3
|
参考答案:C
本题解析:A.对于电解盐酸溶液,相当于电解HCl,盐酸溶液浓度降低,H+浓度降低,pH增大,错误;B.电解NaCl溶液时H+在阴极上放电,阴极附近OH-浓度增大;阳极上Cl-放电,阳极区域H+、OH-浓度基本不变,因而电解后整个溶液pH会变大,错误;C.电解AgNO3溶液时,阴极Ag+放电;阳极是OH-放电,阳极区域H+浓度变大,溶液pH会显著变小,正确;D.电解KNO3的实质是电解水,pH不变,错误;选C。
考点:考查电解的应用。
本题难度:一般
2、实验题 (17分)I.为探究SO2的性质,需要标准状况下11.2 LSO2气体。化学小组同学依据化学方程式Zn+ 2H2SO4(浓)=ZnSO4+SO2↑+2H2O计算后,取32.5g锌粒与质量分数为98%的浓硫酸(密度 ) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。 ) 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是 (用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
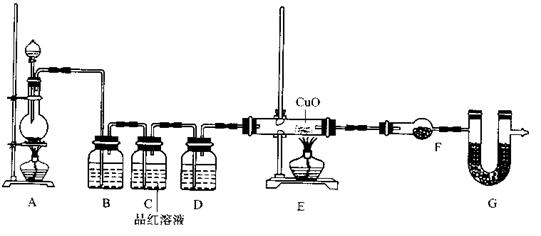
①置B中加入的试剂 ,装置C中品红溶液的作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G加入的试剂 ,作用为 .
II.工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图所示,回答下列问题:
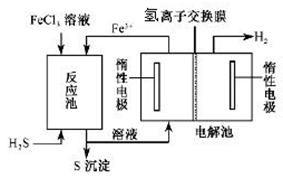
(1)产生反应池中发生反应的化学方程式为 。
(2)反应后的溶液进入电解池,电解时阳极反应式为 。
(3)若电解池中生成5. 6 L H2(标准状况),则理论上在反应池中可生成S沉淀的物质的量为___________ mol。
参考答案:I.(1)H2(1分);随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,
Zn+H2SO4===ZnSO4+H2↑(2分)
(2)①NaOH溶液(或KMnO4,其它合理答案也给分,1分)
证明SO2已被完全除尽。(1分)
②浓硫酸(1分) 无水硫酸铜(1分)
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色(2分)
④碱石灰(1分)防止空气中H2O进入干燥管而影响杂质气体的检验(1分)
II. (1)H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl(2分)
(2)2Fe2+ — 2e- 2Fe3+ (2分) 2Fe3+ (2分)
(3)0.25(2分)
本题解析:I.(1)Zn的物质的量为0.5mol,浓硫酸中含H2SO4为1.84g/mL×60mL×98%÷98g/mol="1.1mol," 随着反应的进行,硫酸浓度降低,当硫酸变为稀硫酸时,发生反应:Zn+H2SO4===ZnSO4+H2↑,所以化学小组所制得的气体中混有的主要杂质气体可能是H2。
(2)①为了防止SO2对H2检验的干扰,装置B中应加入吸收SO2的试剂,NaOH溶液或KMnO4溶液等;装置C中品红溶液的作用是证明SO2已被完全除尽。
②H2还原CuO生成H2O,为了避免原气体中水分的干扰,装置D加入的试剂为浓硫酸;F的作用是检验气体与CuO反应生成了H2O,所以加入的试剂为无水硫酸铜。
③H2还原CuO的实验现象是:装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色。
④为防止外界空气中H2O进入干燥管而影响杂质气体氢气的检验,装置G中应加入碱石灰。
II. (1)根据示意图,反应池加入的FeCl3与H2S为反应物,生成了S,发生了氧化还原反应,所以化学方程式为:H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl
(2)反应后的溶液FeCl2和HCl进入溶液,生成H2的电极为阴极,所以阳极上失去电子的离子为Fe2+,所以阳极反应式为:2Fe2+ — 2e- 2Fe3+ 2Fe3+
(3)根据电解池中电子守恒和反应池的化学方程式可得关系式:S ~ 2Fe2+ ~ H2,所以n(S)=n(H2)=5.6L÷22.4L/mol=0.25mol。
考点:本题考查实验方案的分析、物质的性质、电解的原理及应用。
本题难度:困难
3、选择题 用惰性电极在U型管中电解硝酸钾溶液,一定时间后在两极滴加甲基橙试液,则两极的颜色是
[? ]
阴极 阳极
A. 橙色 橙色
B. 黄色 红色
C. 红色 红色
D. 红色 橙色
参考答案:B
本题解析:
本题难度:简单
4、选择题 用电解法提取氯化铜废液中的铜,方案正确的是(?)
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化铜溶液吸收阴极产物
D.用带火星的木条检验阳极产物
参考答案:B
本题解析:A项是在铂上电镀铜,无法提取铜,错误。利用电解法提取CuCl2溶液中的铜,阴极应发生反应:Cu2++2e-=Cu,阳极可以用碳棒等惰性材料作电极,B项正确。电解时阴极产生铜,无法用NaOH溶液吸收,C项错误。阳极反应:2Cl--2e-=Cl2↑,无法用带火星的木条检验,D项错误。
本题难度:一般
5、填空题 FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
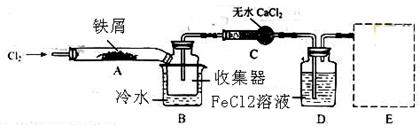
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④........
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;② 。
参考答案:(1)
(2)在沉积的的FeCl3固体下方加热。
(3)②、⑤,
(4)酸性高锰酸钾溶液
(5)
(6)
(7)Fe2+-e-=Fe3+
(8)FeCl3可以循环利用。 (每空2分)
本题解析:(1)A中反应的化学方程式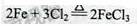
(2)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质,第④的操作应该是:在沉积的的FeCl3固体下方加热。
(3)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2,⑤用干燥的N2赶尽Cl2,
(4)装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,检验FeCl2是否失效就是检验二价铁离子,最好用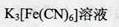 ,也可以用酸性高锰酸钾溶液检验。 ,也可以用酸性高锰酸钾溶液检验。
(5) ,吸收的是氯气,不用考虑防倒吸 ,吸收的是氯气,不用考虑防倒吸
(6)
(7)阳极的电极反应: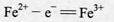
(8)该实验的另一个优点是FeCl3可以循环利用。
考点:考查物质的性质等相关知识。
本题难度:困难
|