1、填空题 理论上讲,任何自发的氧化还原反应都可以设计成原电池.请你利用下列反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池,并回答下列问题:
①该电池的正极材料是______,负极材料是______,电解质溶液是______.
②在外电路中,电流方向是从______极到______极.
③正极上出现的现象是______.负极上出现的现象是______.
参考答案:①根据电池总反应可知,在反应中,Cu被氧化,失电子,应为原电池的负极,则正极为活泼性较Cu弱的金属或非金属,如碳棒,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,故答案为:C;Cu;AgNO3 溶液;
②原电池电流方向从正极经外电路流向正极,电子流向相反,故答案为:正;负;
③原电池工作时,负极反应为Cu-2e-=Cu2+,电极质量不断减小,正极反应为Ag++e=Ag,正极上有银白色物质析出,质量不断增加,故答案为:正极质量增加;负极质量减少.
本题解析:
本题难度:一般
2、填空题 银锌碱性蓄电池是一种可以反复充电、放电的装置.电池放电时的反应原理是:Zn+Ag2O+H2O=2Ag+Zn(OH)2.

现用该蓄电池电解c(NO3-)=6mol?L-1的KNO3和Cu(NO3)2的混合溶液500mL,当通电一段时间后,两极均收集到22.4L气体(标准状况)(电解池的电极均为石墨电极).
回答下列问题:
(1)银锌碱性蓄电池的正极反应式为______.
(2)电解过程中,阳极反应式为______;阴极反应式为______.
(3)上述电解过程中共转移电子总数______.
(4)电解得到的Cu的质量为______.
(5)原混合溶液中c(K+)为______.
(6)电解后溶液中c(H+)______4mol/L(选填“<”“=”“>”).
参考答案:(1)该原电池中,较活泼的金属锌失电子作负极,氧化银作正极,正极上氧化银得电子和水反应生成银和氢氧根离子,电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-.
故答案为:Ag2O+H2O+2e-=2Ag+2OH-.
(2)电解过程中,阳极上氢氧根放电生成氧气和水,4OH--4e-=2H2O+O2↑;阴极上先是铜离子放电生成铜,当铜离子完全析出时,氢离子放电生成氢气,电极反应式为Cu2++2e-=Cu,2H++2e-=H2(或4H2O+4e-=2H2+4OH-).
故答案为:4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu,2H++2e-=H2(或4H2O+4e-=2H2+4OH-).
(3)电解过程中,阳极上失电子,阴极上得电子,根据氧气与转移电子之间的关系式计算.
设转移电子为X.
4OH--4e-=2H2O+O2↑;
? 4NA? 22.4L
? X?22.4L?
X=4NA
故答案为4NA.
(4)氢氧根离子失去4NA 电子析出22.4L氧气转移电子,氢离子得到2NA电子析出22.4L氢气,所以铜离子得到2NA
电子析出铜单质.
设铜单质的质量是y.
Cu2++2e-=Cu?
?2NA? 64g
? 2NA y
?y=64g.
故答案为64g.
(5)铜的质量是64g,其物质的量是1mol,则C(Cu2+)=1mol0.5L=2mol/L,c(NO3-)=6mol?L-1;设钾离子的物质的量浓度为z,根据溶液呈电中性,溶液中阴阳离子所带电量相等得,2C(Cu2+)+C(K+)=c(NO3-),所以
C(K+)=c(NO3-)-2C(Cu2+)=2mol/L.
故答案为:2?mol?L-1 .
(6)根据4OH--4e-=2H2O+O2↑知,生成22.4L氧气需要氢氧根离子4mol,根据2H++2e-=H2↑知,生成22.4L氢气需要氢离子2mol,水电离出的氢离子和氢氧根离子个数相同,所以溶液中氢离子的物质的量是2mol,电解过程中溶液的体积减小,所以c(H+)>2mol0.5L=4mol/L.
故答案为>.
本题解析:
本题难度:简单
3、选择题 把a、b、c、d四块金属分别用导线两两相连浸入稀硫酸中组成原电池。若a、b 相连时a为负极;c、d相连时电流方向由d到c;a、c相连时c极上产生大量气泡;b、d相连时b极发生氧化反应,由此判断四种金属的活动性顺序由强到弱为 (? )
A.a>b>c>d
B.b>d>c>a
C.c>a>b>d
D.a>c>d>b ?
参考答案:D
本题解析:考查原电池的应用。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。据此可以判断四种金属的活动性顺序由强到弱为a>c>d>b,所以正确的答案选D。
本题难度:一般
4、实验题 根据下式所示的氧化还原反应设计一个原电池: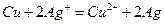
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图。
①注明原电池的正极和负极;
②注明外电路中电子的流向。
(2)写出两个电极上的电极反应。
参考答案:(1)(6分)
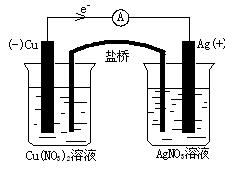 ?
?
(选择其他正极材料和电解质溶液合理亦可)
(2)(每空2分)?负极: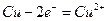 ; 正极:
; 正极: 。
。
本题解析:略
本题难度:简单
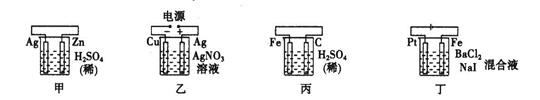
5、选择题 有关甲、乙、丙、丁四个图示的叙述正确的是(?)
A.甲中负极反应式为:2H++2e-=H2↑
B.乙中阳极反应式为:Ag++e-="=" Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阴极产生黄绿色气体