|
高中化学知识点总结《原电池原理》试题预测(2019年最新版)(六)
2020-07-08 00:53:43
【 大 中 小】
|
1、填空题 (12分)某化学兴趣小组利用下图所示原电池装置进行实验,请回答下列问题:
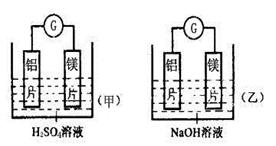
(1)实验中,同学们发现两装置电流计的指针偏转方向不同,因此有人提出以下观点,其中正确的是____________。(双选题,漏选得1分,多选错选得0分)
A.金属活动性铝比镁强
B.金属活动性镁比铝强,两装置中镁均为负极
C.仅根据金属活动性顺序不能准确判断原电池的正负极
D.原电池中的正负极受电解质溶液的酸碱性、强氧化性等因素的影响
| (2)写出甲图中的电极反应式:
①正极:__________________________________________;
②负极:__________________________________________。
(3)乙图中铝片与NaOH溶液反应的总化学方程式为______________________。某同学测得乙图中实验前铝片的质量是10g,实验后的质量是4.6g,则在实验过程中产生氢气的体积为?L(标况),转移电子的物质的量为?mol。
参考答案:(1)CD(双选题,漏选得1分,多选错选得0分)
(2)①2H++2e―==H2↑;?②Mg - 2e―==Mg2+
(3)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑? 6.72L?,0.6mol
本题解析:(1)在一般情况下,原电池中较活泼的金属作负极,较不活泼的金属作正极。但是还需要考虑所用的电解质溶液。由于镁和氢氧化钠不反应,铝和氢氧化钠反应,所以此时作负极的是铝,而不是镁,镁作正极。所以正确的答案是CD。
(2)甲装置中镁是负极,失去电子。铝是正极,溶液中的氢离子得到电子,生成氢气。
(3)铝和氢氧化钠反应生成氢气、偏铝酸钠和水,反应式为2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。根据题意可知,消耗的铝是10g-4.6g=5.4g,物质的量是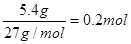 。所以生成氢气是0.3mol,转移电子是0.2mol×3=0.6mol。 。所以生成氢气是0.3mol,转移电子是0.2mol×3=0.6mol。
本题难度:一般
2、填空题 化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素。
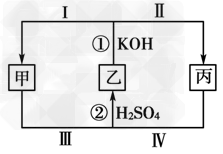
(1)若乙为Cl2,丙为KClO,则:①甲的化学式为________________。
②反应②的化学方程式为_____________________________,该反应中被氧化与被还原的氯元素质量之比为______________。
③若将反应①设计成原电池,正极反应过程为________ (用“Ⅰ”或“Ⅱ”?填空?)。
(2)若甲、乙、丙中所含相同元素X的化合价分别为a、b、c,且a<b<c,反应①进行过程中其他元素化合价不变,则该反应中氧化产物与还原产物中X元素的物质的量之比为______________ (用a、b、c表示)。
参考答案:(1)①KCl;②KCl+KClO+H2SO4===K2SO4+Cl2↑+H2O;1∶1; ③Ⅰ
(2)(b-a)∶(c-b)
本题解析:
本题难度:一般
3、选择题 下图所示装置能够组成原电池,并且能产生明显电流的是(?)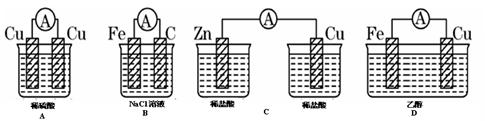
参考答案:B
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中,因此B正确,A中电极相同,C中没有构成回路,D中乙醇不是电解质,答案选B。
点评:该题属于基础性试题,难度不大。该题容易错选C,但选项C中如果添加盐桥则可以构成原电池。
本题难度:一般
4、填空题 依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是____________;
(2)银电极为电池的______________极,发生的电极反应为________________;X电极上发生的电极反应为_______________;
(3)外电路中的电子是从________电极流向________电极。
参考答案:(1)铜;AgNO3溶液
(2)正;Ag++e-→Ag;Cu→Cu2++2e-
(3)铜;银
本题解析:
本题难度:一般
5、选择题 关于下列各装置图的叙述不正确的是( )
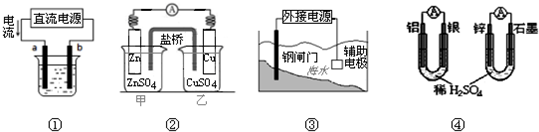
A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向乙烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
参考答案:A、电解精炼铜,粗铜做阳极,精铜做阴极,用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液,故A正确;
B、盐桥是起到平衡电解质液的电荷守恒,甲池中锌离子增多,氯离子移向甲池;图②装置盐桥中KCl的Cl-移向甲烧杯,故B错误;
C、图③装置中钢闸门应与外接电源的负极相连获得保护,电解阴极被保护,故C正确;
D、两个原电池中使铝和稀硫酸反应,锌和稀硫酸反应电子转移相同时铝和锌物质的量不同;图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同,故D正确;
故选B.
本题解析:
本题难度:一般
|