1、选择题 下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:
OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
参考答案:C
本题解析:A、合成氨生产过程中将NH3液化分离,不能加快正反应速率,错误;B、Ba(OH)2与H2SO4反应生成BaSO4沉淀和H2O,该反应的反应热不是中和热,错误;C、电解精炼铜,阳极除了Cu失电子,还有比铜活泼的锌、镍、铁失电子,正确;D、该反应气体的系数不变,增大平衡体系的压强,平衡不移动,与勒夏特列原理无关,错误。
本题难度:一般
2、选择题 原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是?
A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+
B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+,
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
参考答案:B
本题解析:选项A:该原电池中,铝易失去电子而作负极,铜作正极,故A正确;
选项B:由Mg、Al、NaOH溶液组成原电池,铝和氢氧化钠反应易失去电子而作负极,镁作正极,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O,故B不正确;
选项C:该原电池中,铁易失去电子而作负极,铜作正极,其负极反应式为:Fe-2e-═Fe2+,故C正确;
选项D:Al、Cu、浓硝酸组成原电池,铝钝化,所以铜作负极,铝作正极,其负极反应式为:Cu-2e-=Cu2+,故D正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强,注重答题的灵活性,有利于培养学生的逻辑思维能力和发散思维能力。答题时注意不能根据金属的活泼性确定原电池的正负极,要根据电极反应类型判断原电池的正负极。
本题难度:简单
3、选择题 有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
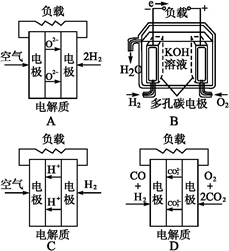
参考答案:C
本题解析:A项,正极反应生成O2-;B项,正极反应生成OH-;C项,正极反应生成H2O;D项,正极反应生成C。
本题难度:一般
4、选择题 如图为番茄电池,下列有关说法中不正确的是
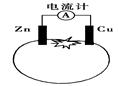
A.一段时间后,铜电极附近会出现蓝色
B.一段时间后,锌片质量会变少
C.锌电极是该电池的负极
D.电流由铜通过导线流向锌
参考答案:A
本题解析:A.一段时间后,铜电极是正极,不会参加反应,错误。B.由于锌片是负极要溶解,质量会变少,正确。C.锌电极是该电池的负极,正确。D.应该是电子由铜通过导线流向锌,错误。
本题难度:一般
5、选择题 有A、B、C、D四种金属,常温下只有C能和水反应生成氢气,B与A用导线相连插入稀硫酸形成原电池时,A电极附近有气泡产生,A能从D的硝酸盐溶液中能把D置换出来,则四种金属失电子能力从强到弱的顺序是( )
A.C>B>A>D
B.C>D>A>B
C.C>A>B>D
D.D>C>B>A
参考答案:由金属活动性顺序表的应用可知,A、B、C、D四种金属,只有C可与稀硫酸反应放出H2,说明了C的活动性大于A、B、D;
又由题意一般活泼性较强的作负极可知,A、B形成原电池时A电极附近有气泡产生,所以A作正极,说明了B的活动性大于A;
A能从D的硝酸盐溶液中能把D置换出来,说明了A的活动性大于D.
综合以上分析可知,四种金属活泼性由强到弱的顺序是C>B>A>D.
故选A.
本题解析:
本题难度:一般