1、选择题 如图为某原电池的结构示意图,下列说法正确的是
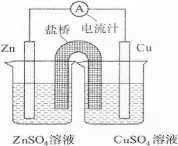
A.原电池工作时,电子从铜极流向锌极
B.原电池工作时,铜电极上发生氧化反应
C.正极反应为Zn—2eˉ=Zn2+
D.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
参考答案:D
本题解析:A、失去电子能力:Zn>Cu,则Zn、Cu分别是负极、正极,电子从负极流向正极,错误;B、负极上发生氧化反应,正极上发生还原反应,错误;C、负极反应式为Zn—2eˉ=Zn2+,正极反应式为Cu2++2eˉ=Cu,错误;D、电池反应式为Zn+Cu2+=Zn2++Cu,符合强制弱原理或能量判据,属于放热反应,正确。
本题难度:简单
2、实验题 (2014届河北省冀州中学高三3月摸底考试理综化学试卷)
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
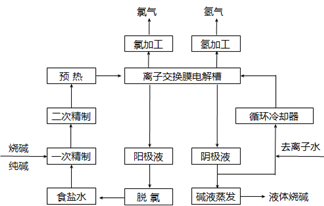
(1)该流程中可以循环的物质是?。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式?,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果?。
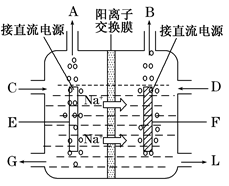
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是?,E电极的名称是?。电解总反应的离子方程式为?。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为?。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为?。
参考答案:(1)氯化钠?氢氧化钠
(2)Ca2++ CO32- = CaCO3↓? Mg2+ + 2OH- = Mg(OH)2↓?用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。
(3)H2 阳极 ?2Cl-+2H2O Cl2↑+H2↑+2 OH-
Cl2↑+H2↑+2 OH-
(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
(5)93.46%
本题解析:
氯碱工业的电解原理是2Cl-+2H2O Cl2↑+H2↑+2OH-。(1)从图上看未电解的NaCl和产物NaOH可以循环使用。(2)粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,一次精制时加入纯碱和烧碱,其中CO32-使Ca2+沉淀,OH-使Mg2+沉淀;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,若食盐水不经过二次精制就直接进入离子膜电解槽,碱性条件下会生成沉淀,损害离子交换膜。
Cl2↑+H2↑+2OH-。(1)从图上看未电解的NaCl和产物NaOH可以循环使用。(2)粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,一次精制时加入纯碱和烧碱,其中CO32-使Ca2+沉淀,OH-使Mg2+沉淀;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,若食盐水不经过二次精制就直接进入离子膜电解槽,碱性条件下会生成沉淀,损害离子交换膜。
(3)图中Na+由左侧通过离子交换膜进入右侧,说明F电极为H+放电,是阴极,B处产生的气体是H2;
E电极是阳极。电解总反应的离子方程式即电解原理。
(4)溶解氯与亚硫酸钠溶液反应,Cl2变成Cl-,亚硫酸钠变成硫酸钠,注意水参与了反应。
(5)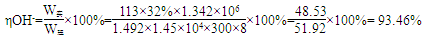
本题难度:一般
3、选择题 两种金属A与B组成原电池时,A是正极。下列有关推断正确的是(? )
A.A的金属性强于B
B.电子不断由A电极经外电路流向B电极
C.A电极上发生的电极发应是还原反应
D.A的金属活动性一定排在氢前面
参考答案:C
本题解析:在原电池中,一般情况下较活泼的金属作负极,失去电子,发生氧化反应。所失去的电子经导线传递到正极上,正极得到电子,发生还原反应。A是正极,说明A的活泼性弱于B的,但A不一定排在氢前面,所以选项C是正确的,答案选C。
本题难度:简单
4、选择题 下列关于下图所示原电池装置的叙述中,正确的是

A.铜片是负极
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
参考答案:D
本题解析:A、该原电池中Zn作负极,Cu作正极,错误;B、正极发生还原反应,所以Cu极有氢气放出,铜片质量不变,错误;C、外电路电流从正极流向负极,所以电流从锌片流向铜片,错误;D、氢离子在正极被还原,正确,答案选D。
本题难度:一般
5、选择题 铜锌原电池(如图所示)是最早被研究的电池。关于该电池的说法中正确的是

A.铜片是负极
B.锌变成了锌离子
C.电子从铜片经导线流向锌片
D.铜片表面没有气泡