1、选择题 关于某溶液中所含离子的检验,下列判断正确的是
A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42-
B.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
参考答案:B
本题解析:A.若原溶液中含有Cl-,会产生AgCl白色既不溶解于水,也不溶于酸的物质。或若原溶液中含有SO32-加入BaCl2溶液,生成白色沉淀,当再加稀硝酸时由于硝酸有强的氧化性,会把BaSO3氧化为BaSO4。沉淀发生转化,不溶解。。错误;B向某溶液中加入2滴KSCN溶液,溶液不显红色确定不含有Fe3+,再向溶液中滴几滴新制的氯水,溶液变为红色,说明原溶液含有Fe2+,氯水将Fe2+氧化为Fe3+,产生血红色。正确;C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定含有Na+,是否含有K+,要必须透过蓝色钴玻璃,若火焰为紫色,就证明含有K+,否则没有K+。错误。D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中可能含有CO32-、HCO3-, HSO3-,或SO32-。错误。42-、Fe3+、Fe2+、Na+、K+、CO32-等离子的检验的知识。
本题难度:一般
2、选择题 下列有关物质检验或鉴别的说法正确的是 ①检验某未知溶液中是否含有SO42-,通常是先向试液中滴加适量稀盐酸,然后再滴加BaCl2溶液;②鉴别氯化钠溶液和氯化钾溶液时,常用玻棒分别蘸取试液放在火焰上灼烧,直接观察火焰的颜色;③向某溶液中加入稀氢氧化钠溶液,若末嗅到氨的气味,则说明该溶液中无铵盐;④某白色固体与强酸溶液接触产生大量无色气体,则该固体一定是碳酸钙;⑤鉴别胶体与溶液最好的方法是观察有无“丁达尔现象”。
A.①②
B.②③
C.①⑤
D.④⑤
参考答案:C
本题解析:①⑤正确;②鉴别氯化钠溶液和氯化钾溶液时,不能直接观察火焰的颜色,要用蓝色的钴玻璃观察;③检验铵根离子,要用浓氢氧化钠溶液;④某白色固体与强酸溶液接触产生大量无色气体,则该固体不一定是碳酸钙,也可能是碳酸钡、碳酸钠、碳酸氢钠等。
点评:属于简单题。
本题难度:一般
3、选择题 下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
?
| A
| B
| C
| D
|
X
| FeCl2溶液
| Mg
| FeCl3溶液
| Na2SO4溶液
|
Y
| FeCl3
| Al
| CuCl2
| Na2CO3
|
Z
| Cl2
| NaOH溶液
| Fe
| BaCl2溶液
参考答案:B
本题解析:A项:加入Cl2把主体物质反应了,不合题意,故错。C项:Fe既可以与杂质CuCl2反应也可以与主体物质FeCl3溶液,生成新的杂质,故错。D项:BaCl2溶液与杂质BaCl2溶液反应,会生成新的杂质,故错。故选B。
点评:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
本题难度:一般
4、实验题 废旧电池进入环境后,对人体带来一系列的致畸、致癌、致变等危害。废电池中主要有铜帽(含Cu、Zn)、锌壳、铁片、石墨、填充物(MnO2、NH4Cl),对废旧电池进行资源化处理的工艺流程如下:
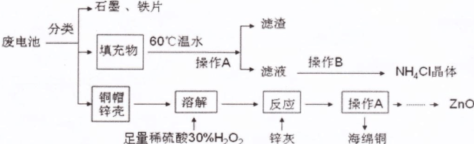
(1)操作A的名称为?,滤渣的成分为?。
(2)填充物用60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,其原因是?。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)?。铜帽溶解完全后,需将溶液中过量的H2O2除去,除去H2O2的简便方法是?。
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,其负极的电极反应式为?。
参考答案:(14分)(1)过滤(2分)? MnO2(2分)
(2)防止高温下NH4Cl分解(2分,其它合理解释也给分)
(3)①Cu+H2O2+H2SO4==CuSO4+2H2O(3分,不配平扣1分,化学式错不给分)
②加热(2分)
(4)Zn-2eˉ+2OHˉ==Zn(OH)2(3分)
本题解析:(1)根据混合物分离提纯的方法可知,得到滤渣和滤液的方法是过滤,则操作A的名称为过滤或趁热过滤,用60℃温水溶解MnO2、NH4Cl的混合物,得到的滤渣是MnO2,为了防止冷却时结晶析出NH4Cl,加入的蒸馏水需过量,且最好趁热过滤;(2)首先,NH4Cl是强酸弱碱盐,温度太高促进其彻底水解,变为受热易分解的NH3?H2O和易挥发的HCl,降低NH4Cl的产率;其次,温度太高,NH4Cl受热易分解为NH3和HCl气体;(3)Cu是氢后金属,不能直接溶于稀硫酸,过氧化氢是常见的氧化剂,在酸性条件下能溶解铜单质,根据化合价升降总数相等、铜硫氢等原子守恒可得:Cu+H2O2+H2SO4==CuSO4+2H2O;除杂试剂需过量,过量试剂需除去,双氧水受热依分解,硫酸铜可以催化其分解,因此加热是除去过氧化氢的简便方法;而加入过量的锌灰(Zn)可以除去Cu2+、过量的稀硫酸,过滤得到的滤渣为海绵铜(Cu),滤液为硫酸锌溶液,以滤液为原料可以制备ZnO;(4)根据总反应式中化合价升高的元素可知,负极的主要反应物→产物为:Zn→Zn(OH)2;由化合价升高总数等于失去电子数可得:Zn-2eˉ→Zn(OH)2;根据电荷守恒和原子守恒可知,负极反应式为Zn-2eˉ+2OHˉ==Zn(OH)2。
本题难度:一般
5、选择题 为除去括号内的杂质,所选用的试剂或方法正确的是
[? ]
A.C2H6(C2H4)通入溴的四氯化碳溶液中
B.CH3COOC2H5(C2H5OH)用分液漏斗进行分液
C.NaNO3(NaCl) 用冷却热饱和溶液的方法分离
D.SO2(SO3)用排饱和NaHCO3溶液的方法
参考答案:C
本题解析:
本题难度:一般
|