1、选择题 镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是(?)
A.Li2SO4能溶于水
B.LiOH是易溶于水、受热不分解的强碱
C.Li遇浓硫酸不产生“钝化”现象
D.Li2CO3受热分解,生成Li2O和CO2
2、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/pm
| 160
| 143
| 70
| 66
|
主要化合价
| +2
| +3
| +5 、+3、 -3
| -2
|
?
下列-叙述正确的是
A.X、Y元素的金属性X<Y?
B.Z的气态氢化物比W的气态氢化物稳定
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.X能在Z 的单质中燃烧
3、选择题 X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是(? )?
A.原子序数: X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.原子最外层电子数:X<Y
4、选择题 下列属于同位素的一组是
A.H2O和D2O
B.金刚石和石墨
C.氕、氘、氚
D.40K、40Ca
5、填空题 (15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号?,该能层具有的原子轨道数为?;
⑵E2+离子的价层电子排布图是?,F原子的电子排布式是?;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为?,? B元素的气态氢化物的VSEPR模型为?;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为?;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为?;
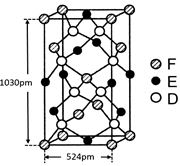
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为?,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d=?g/cm3。