1、选择题 镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是(?)
A.Li2SO4能溶于水
B.LiOH是易溶于水、受热不分解的强碱
C.Li遇浓硫酸不产生“钝化”现象
D.Li2CO3受热分解,生成Li2O和CO2
参考答案:B
本题解析:根据题中信息,将镁的有关性质进行迁移应用,可推测锂的有关性质。由Mg、Mg(OH)2、MgCO3、MgSO4的性质推测相应的Li及其化合物的性质。MgSO4易溶于水,Mg(OH)2是难溶、易分解的中强碱,Mg与浓硫酸能发生反应,MgCO3受热易分解生成MgO和CO2,故B项不正确。
本题难度:一般
2、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/pm
| 160
| 143
| 70
| 66
|
主要化合价
| +2
| +3
| +5 、+3、 -3
| -2
|
?
下列-叙述正确的是
A.X、Y元素的金属性X<Y?
B.Z的气态氢化物比W的气态氢化物稳定
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.X能在Z 的单质中燃烧
参考答案:D
本题解析:W化合价为-2价,没有最高正化合价+6价,W为氧元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为氮元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为镁元素,Y为铝元素。
A、同周期自左而右,金属性减弱,所以X、Y元素的金属性X>Y,故A错误;
B、氮元素的非金属性弱于氧元素的,非金属性越强,氢化物的温度下越强,则氨气的温度下弱于水的,故B错误;
C、Y的最高价氧化物的水化物是氢氧化铝,属于两性氢氧化物,但不能溶于弱碱氨水中,故C错误;
D、镁在氮气中燃烧,生成氮化镁,故D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,侧重考查学生灵活运用元素周期律解决实际问题的能力的培养。答题时从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键。
本题难度:一般
3、选择题 X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是(? )?
A.原子序数: X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.原子最外层电子数:X<Y
参考答案:D
本题解析:做这类题最好用特殊值法,例如X我们可以认定它为钠,Y为氟,所以X的原子序数大于Y所以A选项是错误的。B选项,电子层数越多半径越大,所以Y的半径较小。C选项电子层数相同时,原子半径随原子序数的增大而减小所以X较小。D选项氟的最外层电子为7个,钠为1个所以答案选A
本题难度:一般
4、选择题 下列属于同位素的一组是
A.H2O和D2O
B.金刚石和石墨
C.氕、氘、氚
D.40K、40Ca
参考答案:C
本题解析:质子数相同,质量数不同的核素互称为同位素。B是同素异形体,所以答案是C。
本题难度:简单
5、填空题 (15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号?,该能层具有的原子轨道数为?;
⑵E2+离子的价层电子排布图是?,F原子的电子排布式是?;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为?,? B元素的气态氢化物的VSEPR模型为?;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为?;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为?;
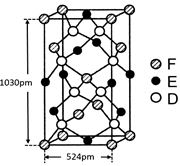
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为?,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d=?g/cm3。
参考答案:⑴M?9个?⑵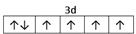 ? 1s22s22p63s23p63d104s1 (或[Ar]3d104s1) ;
? 1s22s22p63s23p63d104s1 (或[Ar]3d104s1) ;
⑶ sp2 ; 四面体 ;⑷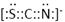 ; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;
; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;
⑹CuFeS2?;?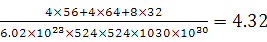
本题解析:根据题意可得A是C;B是N;C是O;D是S;E是Fe;F是Cu。⑴基态S原子核外电子排布是1s22s22p63s23p4,可见电子占据的最高能层是M层;在M能层有1个s轨道、3个p轨道、5个d轨道,一共具有的原子轨道数是9个。⑵Fe2+离子的价层电子排布图是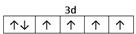 ;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar]3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为
;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar]3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为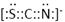 。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6] 3+。配合物甲的化学式是K3[Fe(CN)6]. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6].溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2?;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6] 3+。配合物甲的化学式是K3[Fe(CN)6]. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6].溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2?;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度: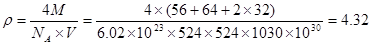 g/cm3。
g/cm3。
本题难度:一般