1、填空题 (本题共12分)合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡。
23.氨分子的电子式为_________,氮元素原子最外层电子排布的轨道表示式是________。
24.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:

根据上图,计算从反应开始到平衡时,氢气的平均反应速率为___________________。
25.催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式: ;该反应中氧化产物与还原产物的物质的量之比为 。
26.pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
27.氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 。该工艺选择氯气的优点是 。(答出一点即可)
参考答案:23、 (1分)、
(1分)、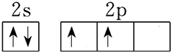 (1分);24.0.0375 mol/(L·min)(2分)
(1分);24.0.0375 mol/(L·min)(2分)
25.4NH3+6NO 5N2+6H2O (2分);2:3(1分) 26.>(2分);
5N2+6H2O (2分);2:3(1分) 26.>(2分);
27.3Cl2 + 2NH4++ 8OH-→ N2↑ + 6Cl- + 8H2O。(2分)
就近取材,利用氯碱工业的产品氯气为原料;不会引入其他杂质离子。(1分)
本题解析:23、氨气是含有极性键的共价化合物,则氨分子的电子式为 ;氮元素的原子序数是7,则根据核外电子排布规律可知原子最外层电子排布的轨道表示式是
;氮元素的原子序数是7,则根据核外电子排布规律可知原子最外层电子排布的轨道表示式是 。
。
24、根据图像可知反应进行到4min时反应达到平衡状态,此时氨气的浓度是0.1mol/L,则根据方程式可知消耗氢气的浓度是0.15mol/L,所以用氢气表示的反应速率是0.15mol/L÷4min=0.0375 mol/(L·min)。
25、催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质,则根据原子守恒可知两种物质应该是氮气和CO2,所以反应的化学方程式为4NH3+6NO 5N2+6H2O。在该反应中氧化产物与还原产物均是氮气,其中还原剂是氨气,氧化剂是NO,所以氧化产物与还原产物的物质的量之比为2:3。
5N2+6H2O。在该反应中氧化产物与还原产物均是氮气,其中还原剂是氨气,氧化剂是NO,所以氧化产物与还原产物的物质的量之比为2:3。
26、氨水是弱碱存在电离平衡,稀释促进电离,所以pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,如果稀释后两溶液的pH仍相同,则m>n;
27、在碱性条件下氯气把铵根氧化生成氮气,氯气的还原产物是氯化氢,则该反应的离子方程式为3Cl2 + 2NH4++ 8OH-→ N2↑ + 6Cl- + 8H2O。由于氯碱厂能生产氯气,所以该工艺选择氯气的优点是就近取材,利用氯碱工业的产品氯气为原料;不会引入其他杂质离子。
考点:考查核外电子排布、反应速率计算、弱电解质的电离以及氧化还原反应应用等
本题难度:困难
2、填空题 (1)平衡常数K表示可逆反应的进行程度,K值越大,表示______
(2)大小与温度的关系是:温度升高,K值______(填一定增大、一定减小、或可能增大也可能减小).
参考答案:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,K越大,说明生成物越多,反应物越少,所以可逆反应进行的程度越大,故答案为:可逆反应进行的程度越大;
(2)当反应放热时,升高温度平衡向逆反应方向移动,当反应吸热时,升高温度平衡向正反应方向移动,温度升高,K可能增大,也可能减小,
故答案为:可能增大也可能减小.
本题解析:
本题难度:一般
3、选择题 对于可逆反应aA(g)+bB(g) cC(g)+dD(g)在t1时刻增大压强,其速率与时间图像如下
cC(g)+dD(g)在t1时刻增大压强,其速率与时间图像如下
则下列关系式正确的是
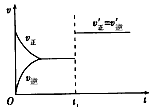
[? ]
A.a+b>c+d
B.a+b c+d
c+d
C.a+b=c+d
D.无法判断
参考答案:C
本题解析:
本题难度:一般
4、选择题 一定温度下,某密闭容器中发生如下反应:A(g)+B(g)?C(g)+D(g)△H<0.当反应达到平衡时测得容器中各种物质均为amol.欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是( )
A.降低温度
B.恒容时,再通入2amolC和2amolD
C.使容器的体积缩小一半
D.恒容时,再通入amolA和amolB
参考答案:A、降低温度平衡正向进行,若使C的浓度增大为2a,amolA,amolB必须全部转化才符合,但温度降低不能使反应进行完全,故A错误;
B、根据反应达到平衡时测得容器中各种物质均为amol,对于反应,A(g)+B(g)?C(g)+D(g)相当于起始量为2amolA,2amolB进行的反应,再通入2amolC和2amolD,相当于增大了体系的压强,但反应是体积不变的反应,所以平衡不动,C的物质的量增大为原来的1倍,即2amol,故B正确;
C、使容器的体积缩小一半,平衡不动,但各物质的浓度增大为原来的一倍,所以C的浓度增大一倍,故C正确;
D、恒容时,再通入amolA和amolB,在完全转化时C的浓度才增大为原来的一倍,但反应不可能完全转化,所以C的浓度增大小于原来的一倍,故D错误;
故选BC.
本题解析:
本题难度:一般
5、选择题 在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A.反应物浓度:a点小于c点
B.c点时反应进行的程度最大
C.该反应的正反应为吸热反应
D.△t1=△t2时,生成H2的物质的量:a~b段小于b~c段
参考答案:D
本题解析:反应起始时反应物浓度大,因此反应物浓度:a点大于c点,A项错;c点反应速率最大,反应不一定处于平衡态,而反应进行程度最大是指反应达到平衡态,B项错;反应起始阶段,反应物浓度减少而反应速率加快,只能是温度升高导致,再结合容器不导热可知正反应为放热反应,C项错;反应速率a~b小于b~c,故等同时间内,生成H2的量,a~b段小于b~c段,D项正确。
本题难度:一般