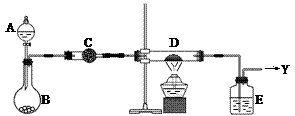
1、实验题 (16分)如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是?(用a~p中的字母表示),其作用是?。
⑵A中溶液和B中固体的所有可能的组合共有?种。
⑶纯净气体X通过D时,发生反应的化学方程式是?,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重?g。
⑷E中的药品是?(用a~p中的字母表示),其作用是?。
参考答案:⑴i(或k,或m,2分);干燥氨气(2分)
⑵3(3分)
⑶2NH3+3CuO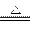 N2+3Cu+3H2O(2分);9.6(3分)
N2+3Cu+3H2O(2分);9.6(3分)
⑷a(2分);吸收水蒸汽及未反应的NH3(2分)。
本题解析:(1)由题意“单质Y在标准状况下的密度为1.25g/L”可知,M(Y)=28,单质Y为N2。又X气体通过D时,黑色粉末逐渐变成红色,且生成N2,X分子中含有10个电子,那么X为氨气。黑色粉末为CuO。(2)A中溶液和B中固体的所有可能的组合为:浓氨水与生石灰,浓氨水与固体烧碱,硝酸铵晶体与稀NaOH溶液。,共3组。(3)转移电子的物质的量为1.8mol时,参与反应的CuO的物质的量为0.9mol,CuO共失重为:0.9×16=14.4g。⑷E中的药品是用来吸收氨气和水蒸汽,要用浓硫酸。
本题难度:一般
2、实验题 (本题16分)Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置适合作尾气吸收的是?(填序号)。
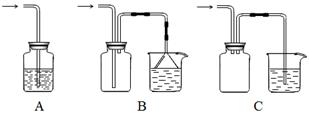
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是___________(至少填两种)如果要证明X是SO2气体,接下来的操作是:________________________________
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,_________后,再滴入几滴植物油;
(2)选择装置___________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
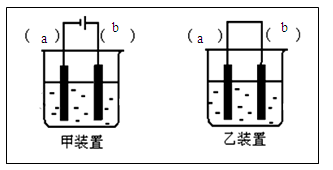
(3)在你选择的装置上标明电极材料分别为____________、________________
(4)实验中可在___________看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是______________
参考答案:
Ⅰ.(1)BC(2分)
(2)SO2、Cl2(O3、ClO2等)(2分)将褪色后的溶液再加热,如果溶液又恢复成红色,则X一定为SO2(2分)
Ⅱ.(1)加热煮沸(2分)
(2)装置甲 (2分)
(3)b-Fe (1分) a-石墨(Fe) (1分)
(4)阳极附近溶液中 (2分)
(5)将电极反向连接 (2分)
本题解析:
Ⅰ.(1)本题答题要从防止倒吸的角度去想。
(2)能使品红褪色的可马上想到SO2,再细想一下还有Cl2、O3、ClO2,如果要证明通入的是二氧化硫,则要用试管取褪色后的溶液,用酒精灯进行加热,看是否能恢复颜色;本题答题时一定要有操作、现象、结论
Ⅱ.本题要注意目的为了制备Fe(OH)2,观察其颜色,所以关键是所用的试剂要除O2,装置要隔绝空气,(1)溶液要除氧气则用加热煮沸的方法,温度升高,气体在水是的溶解度下降(2)甲和乙装置的区别在于有无外接电源,做这种题是二选一的情况,可以用假设选用一装置,代入题意;从本题的角度,可知要产生二价铁离子,再和氢氧根离子反应,所以要选用电解池,即甲装置;b电极为阳极产生二价铁离子则为Fe,a电极为石墨;因为阳极上产生二价铁离子,所以白色沉淀在阳极的附近可观察到,如果要想白色沉淀转化为红褐色沉淀,则要加入氧化剂,从题意中不能加入,但如果将电极反接,相当于用惰性电极电解氢氧化钠溶液,即电解水,氧气就可产生了,也就实现了转化。
本题难度:一般
3、实验题 实验室制备溴苯可用如图所示的装置,填写下列空白:

(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,反应一段时间制的溴苯。溴苯是一种密度比水?(填”小”或”大”)的无色液体,在实验中因为?而显褐色。则三口烧瓶中发生反应的化学方程式为___?__和__?_。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是__________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
参考答案:⑴ 大?溶有Br2?2Fe+3Br2=2FeBr3?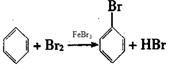
⑵ D管石蕊试液变红(1分),E管出现浅黄色沉淀。
⑶水倒流进三口烧瓶。
⑷吸收HBr和Br2 ?干燥?(5) 苯? C
本题解析:(1)在催化剂的作用下,苯和液溴发生取代反应生成溴苯,有关反应的化学方程式分别是
2Fe+3Br2=2FeBr3 、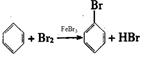 。溴苯是一种密度比水大的无色液体,在实验中因为溶有Br2而显褐色。(2)由于生成的溴化氢易挥发,溶于水显酸性,则D中紫色石蕊试液变红;溴化氢溶于水和硝酸银反应生成溴化银淡黄色沉淀,E中实验现象是溶液中有淡黄色沉淀生成。(3)由于溴化氢极易溶于水,所以待三颈烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是与F相连的广口瓶中水倒流入三颈烧瓶。(4)②由于溴苯中溶有溴化氢与单质溴,所以氢氧化钠溶液洗涤的作用是吸收HBr和Br2。③氯化钙是常用的干燥剂,其干燥作用。(5)苯易溶在溴苯中,且和氢氧化钠溶液不反应,所以粗溴苯中还含有的主要杂质为苯,二者的沸点相差较大,蒸馏即可分离,选C。
。溴苯是一种密度比水大的无色液体,在实验中因为溶有Br2而显褐色。(2)由于生成的溴化氢易挥发,溶于水显酸性,则D中紫色石蕊试液变红;溴化氢溶于水和硝酸银反应生成溴化银淡黄色沉淀,E中实验现象是溶液中有淡黄色沉淀生成。(3)由于溴化氢极易溶于水,所以待三颈烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C夹,可以看到的现象是与F相连的广口瓶中水倒流入三颈烧瓶。(4)②由于溴苯中溶有溴化氢与单质溴,所以氢氧化钠溶液洗涤的作用是吸收HBr和Br2。③氯化钙是常用的干燥剂,其干燥作用。(5)苯易溶在溴苯中,且和氢氧化钠溶液不反应,所以粗溴苯中还含有的主要杂质为苯,二者的沸点相差较大,蒸馏即可分离,选C。
本题难度:一般
4、填空题 (15分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。
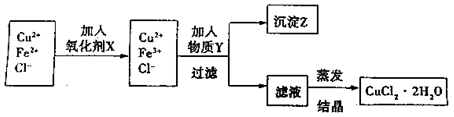
已知:
?
| 氢氧化物开 始沉淀时的pH 始沉淀时的pH
| 氢氧化物沉淀完全时的pH
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
|
?试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是? 。(填序号)
。(填序号)
A.KMnO4? B.K2Cr2O4? C.H2O2? D.NaClO
(2)①加紧入的物质Y是 ?。
?。
②写出沉淀Z在水中的沉淀溶解平衡方程式:?。
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2·2H2O),应采取的措施是?。?
(4)①某同学利用反应:Cu+2H+===Cu2 ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为?。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为?。(填“原电池”或“电解池”)
②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。

(5)已知一些难溶物的浓度积常数如下表:
物质
| FeS
| MnS
| CuS
| PbS
| HgS
| ZnS
|
Ksp
| 6.3×10-18
| 2.5×-13
| 1.3×10-36
| 3.4×10-28
| 6.4×10-53
| 1.6×10-24
|
?某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的?除去它们。(选填序号)
①NaOH?②FeS?③Na2S
参考答案:(1)C(2分)?(2)①CuO或Cu(OH)2或CuCO3(2分)
②Fe(OH)5(s)) ?Fe2+(aq)+3OH-(aq)(2分)
?Fe2+(aq)+3OH-(aq)(2分)
(3)在HCl气流下加热浓缩,冷却结晶(2分)
(4)①电解池(2分)?②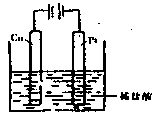 (3分)
(3分)
(5)②(2分)
本题解析:(1)除杂不能引入新的杂质,所以选择C。
(2)Y是来调节溶液的pH的,且不能引入新杂质,故可以选择uO或Cu(OH)2或CuCO3。
(3)氯化铜在溶液中发生水解,加热会进一步促进水解,所以必须在HCl气流下加热浓缩,冷却结晶。
(4)由Cu+2H+===Cu2 ++H2↑可知该装置只能是电解池,因为铜和酸反应不能置换出氢气。因为铜失去电子,所以只能作阳极,电解质含有氢离子的酸即可。
++H2↑可知该装置只能是电解池,因为铜和酸反应不能置换出氢气。因为铜失去电子,所以只能作阳极,电解质含有氢离子的酸即可。
(5)根据沉淀转化的实质②最好,①③属于可溶性物质,易引入新杂质。
本题难度:一般
5、实验题 (15分)某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,
又可用于验证物质的性质。
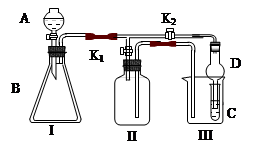
(1)利用I、II装置制取气体(K2闭,K1打开)甲同学认为:利用II装置可以收集H2、NH3等气体,但不能收集O2和NO 等气体,其理由是:__________________________________
____________________________________________________________________
乙同学认为:利用II装置作简单改进,(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用II装置再作简单改进(不改变仪器装置),还可收集NO2气体,改进方法___________________________。
(2)利用I、III装置验证物质的性质(K2打开,K1关闭),如设计证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加___________,C中加_________,观察到C中的现象是_________________?_?。
(3) 请利用I、III 装置自行设计有机实验,写出实验所用的试剂,简述C中的实验现象及根据此现象所得结论。
A中加___________,B中加___________,C中加____________
现象:____________________,结论:_________________________________________。
参考答案:(1) 氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应;
将II装置加满水;?将II装置中加难挥发的有机溶剂。?
(2) KMnO4固体;NaBr 溶液;溶液呈橙色。?
(3) A-水或饱和食盐水;B-电石;C-溴水或酸性高锰酸钾溶液;溴水或酸性高锰酸钾溶液褪色;乙炔为不饱和的化合物。? (或A-盐酸;B-大理石;C-苯酚钠溶液;变浑浊;酸性HCl>H2CO3>C6H5OH )
本题解析:(1)根据装置图可知,该装置适用于收集密度小于空气的,且与空气不反应的气体。由于氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应,所以不能用该装置收集氧气和NO。要在不改变装置的前提下收集氧气和NO2,则将II装置加满水即可。由于NO2能和水反应,因此要收集NO2,只需要将水换成难挥发的有机溶剂即可。
(2)酸性高锰酸钾溶液能氧化浓盐酸生成氯气,所以在B中加入高锰酸钾固体即可。氯气能置换出单质溴,所以在C中放溴化钠溶液即可,溴水显橙色,所以通入氯气后C中溶液显橙色。
(3)根据装置特点可知,可以验证乙酸、碳酸和苯酚的酸性强弱,或者验证乙炔的化学性质。
本题难度:一般