1、选择题 下列气体的收集方法正确的是( )
A.Cl2(既能用排水法收集也能用排空气法收集)
B.NO2(既能用排水法收集也能用排空气法收集)
C.NO(既能用排水法收集也能用排空气法收集)
D.O2(既能用排水法收集也能用排空气法收集)
参考答案:A.Cl2和空气不反应且密度比空气大,可以采用排空气法收集,但氯气能溶于水,不能用排水法收集,故A错误;
B.NO2和空气中不反应且密度比空气大,可以采用排空气法收集,但NO2能与水反应,不能用排水法收集,故B错误;
C.NO和空气中的氧气反应,且密度比空气相差不大,不能采用排空气法收集,但NO不溶于水,能用排水法收集,故C错误;
D.O2和空气不反应且密度比空气大,可以采用排空气法收集,O2不溶于水,可以用排水法收集,故D正确;
故选:D;
本题解析:
本题难度:简单
2、选择题 某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2, 极易与H2O反应),下列说法正确的是
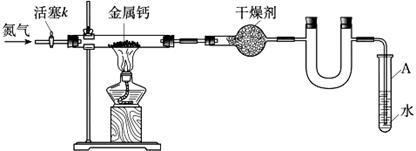
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以用碱 石灰,也可以用浓硫酸
石灰,也可以用浓硫酸
C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
D.将产物Ca3N2放入盐酸中,只能得到一种盐
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (7分)⑴用18mol/L浓硫酸配制100mL 1.0mol/L的稀硫酸,若实验仪器有:
A.100mL量筒? B.玻璃棒 ? C.托盘天平 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时必须选用的仪器是(填入字母)?
⑵在配制过程中,下列操作不正确的是?A.使用容量瓶前需检查它是否漏水
B.容量瓶用蒸馏水洗净后,一定要干燥后再使用
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
⑶若实验时遇到下列情况,将使所配溶液的浓度?(填“偏高”、“偏低”或“无影响”)
A.定容时俯视读数??B.未将洗涤液转入容量瓶??
C.洗涤量筒,并将洗涤液转入容量瓶?
参考答案:(7分)(1)BEFGH(2分)?(2)BC (2分)
(3)偏高?偏低?偏高(每空1分)
本题解析:(1)所需浓硫酸的体积为18×V=0.1×1,得V=0.0056L=5.6ml,故需要用到10mL量筒、玻璃棒、烧杯、胶头滴管、100mL容量瓶
(2)A:正确
B:容量瓶没有必要干燥
C:硫酸必须在烧杯中溶解稀释冷却后再移液至容量瓶
D:正确
(3)A:加水偏少,所配溶液浓度偏高
B:未将洗涤液转入容量瓶,导致部分溶质未转移至容量瓶中,浓度偏低
C:量筒不必洗涤,否则溶质偏多,溶液浓度偏高
本题难度:简单
4、选择题 用氨水、盐酸、氢氧化钠中的任何一种溶液能鉴别的溶液组是(?)
①AgNO3和Al(NO3)3?②Na2CO3和BaCl2?③FeCl3和Fe2(SO4)3?④NH4HCO3和MgCl2
A.只有①
B.只有④
C.①和④都能
D.全部都能
参考答案:C
本题解析:①和④组均可用氨水、盐酸、氢氧化钠中的任何一种溶液能鉴别;②组只能用盐酸鉴别;氨水、盐酸、氢氧化钠中的任何一种溶液都不能鉴别③组中的物质。
本题难度:简单
5、实验题 (14分)现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
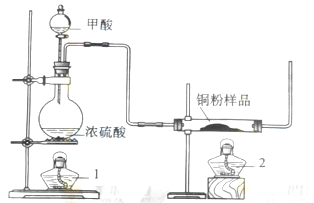 .(1)制备一氧化碳的化学方程式是?;
.(1)制备一氧化碳的化学方程式是?;
(2)实验中,观察到反应管中发生的现象时?;尾气的主要成分是?;
(3)反应完成后,正确的操作顺序为?(填字母)
a.关闭漏斗开关? b.熄灭酒精1? c.熄灭酒精灯2
(4)若实验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为?;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)? _________________________________________________________;
②写出有关反应的化学方程式?。
参考答案:(14分)
(1)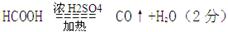
(2)样品粉末逐渐变为红色(2分)? CO、 CO2?(2分)(写对一个给1分)
(3)c a b?(2分)(错任一处不得分)
(4)80%(2分)
(5)①将浓硫酸稀释,称取一定量的样品,样品与过量稀硫酸充分反应,过滤、洗涤、干燥、称量、计算(2分)(用浓硫酸得0分,浓硫酸没稀释,但知道用稀硫酸扣1分,操作正确1分,不写计算也给分)?②CuO+H2SO4=CuSO4+H2O(2分)
本题解析:首先要明确实验目的:制取一氧化碳,测定铜的含量,围绕这一实验目的展开装置、仪器、操作、数据处理等分析。
(1)利用图中所示装置制取CO,并用以测定某铜粉样品中金属铜的含量。装置左边图是制取CO的,反应物为HCOOH和浓硫酸,注意浓硫酸在此做催化剂和脱水剂,HCOOH脱水得到CO;
(2)右边反应管中有黑色CuO和CO反应生成红色的铜单质;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作的原因是防止空气中O2进入右边装置铜又被氧化为氧化铜了;
(4)由氧化铜变为铜产生质量差,可计算铜粉样品5.0g中的铜为4.0g,
则原样品中单质铜的质量分数为4.0÷5.0==80%;
(5)用所给试剂,设计一个测定样品中金属铜质量分数的方案,可用硫酸反应掉氧化铜,过滤称取铜的质量即可。所以操作过程为将浓硫酸稀释,称取一定量的样品,样品与过量稀硫酸充分反应,过滤、洗涤、干燥、称量、计算。
点评:实验题的分析思路:先要明确实验目的,然后再分析实验原理、装置的作用,试剂的选择、数据的处理、现象与数据对结论的关系。
本题难度:一般