1、选择题 下列气体中,既能用浓硫酸干燥又能用碱石灰干燥的是( )
A.O2
B.SO2
C.NH3
D.Cl2
参考答案:A、氧气为中性气体,既能用浓硫酸干燥又能用碱石灰干燥,故A正确;
B、二氧化硫为酸性氧化物,能够与碱石灰反应,不能使用碱石灰干燥,故B错误;
C、氨气为碱性气体,不能用浓硫酸干燥,故C错误;
D、氯气能够与碱石灰反应,不能使用碱石灰干燥,故D错误;
故选A.
本题解析:
本题难度:一般
2、选择题 以下气体能用NaOH固体干燥的是
A.NH3
B.SO2
C.CO2
D.HCl
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列气体不能用排空气法收集的是(?)
A.H2
B.NO2
C.NO
D.NH3
参考答案:C
本题解析:NO极易被氧气氧化生成NO2,所以NO不能用排空气法收集。答案选C。
本题难度:简单
4、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4C1、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
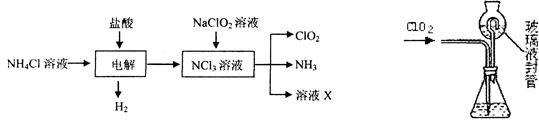
⑴ 写出电解时发生反应的化学方式:?。
⑵ 测定ClO2(如右图)的过程如下:在锥形瓶中加入足最的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
① ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为:?。
② 装置中玻璃液封管的作用是?、?。
③ 滴定至终点的现象是?。
④ 测得ClO2的质量m(ClO2)=?。(用含c、V的代数式表示)
参考答案:⑴ NH4Cl+2HCl=3H2↑+NCl3(1分)
⑵①2ClO2+10I-+8H+=2Cl-+5I2+4H2O(1分)
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等(2分)
③ 溶液由蓝色恰好变为无色,且半分钟内不褪色(1分)
④ 1.35cV×10-2 g(1分)
本题解析:(1)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3,其电解反应方程式为:NH4Cl+2HCl 3H2↑+NCl3.
3H2↑+NCl3.
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③淀粉溶液作指示剂,结合反应I2+2S2O32-=2I-+S4O62-可以判断溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点。
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2?10
n(ClO2)?c?V?10-3 mol
所以n(ClO2)=1/5c?V?10-3 mol.
所以m(ClO2)=1/5c?V?10-3 mol×67.5g/mol=1.35cv×10-2g.
本题难度:困难
5、实验题 无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
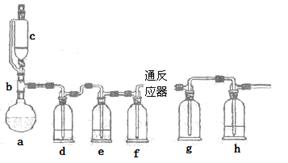
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式?。
(2)d、e盛装的药品分别是?和?,f、g的作用是?。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为?
②实验操作顺序是:组装仪器、?、装入药品、?、?、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
?
| 观察到的部分现象
|
第一次实验
| 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体
|
第二次实验
| 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体
|
第三次实验
| 反应器中有绿色晶体,g瓶有黄绿色气体
|
?
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是?。
②第二次实验,g瓶有红棕色的烟,其原因是?。
(5)第三次实验得到的固体,最可能含有微量杂质是?,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是?。
参考答案:(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O?(用次氯酸盐也可)
(2)饱和食盐水、浓硫酸?安全、防止倒吸?
(3) ①Fe+Cl2 ?FeCl2?②检验装置的气密性、先加热、 再打开c的活塞?
?FeCl2?②检验装置的气密性、先加热、 再打开c的活塞?
(4)①氯气没有干燥,生成的盐发生水解,生成了氢氧化物,最终分解得到三氧化二铁
②加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中
(5)铁单质?铁单质可以防止Fe2+被氧化
本题解析:
?
?试题分析:在实验室中在常温下一般用高锰酸钾溶液和浓盐酸发生反应来制取氯气。反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。(2)由于浓HCl有挥发性,而且反应是在溶液中制取的,所以氯气中含有杂质HCl和水蒸气。在d装置中用饱和的食盐水来除去HCl;在装置e盛装有浓硫酸来对氯气进行干燥。f、g的作用是作为安全瓶来防止倒吸现象的发生。(3)①纯净铁粉与氯气在500℃左右反应制取FeCl2。化学反应方程式为Fe+Cl2 FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
本题难度:一般