1、填空题 下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
?
请回答下列问题:
(1)Z的元素符号是?,写出Z的原子结构示意图:?。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为?。
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
编号
| 性质推测
| 化学方程式
|
示例
| 氧化性
| H2ZO3+4HI=Z↓+2I2+3H2O
|
1
| ?
| ?
|
2
| ?
| ?
|
?
(4)由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:?。
参考答案:(1)Se?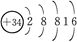
(2)SiO2+2OH-=SiO32-+H2O
(3)
1
还原性
2H2SeO3+O2=2H2SeO4(或Br2+H2SeO3+H2O=H2SeO4+2HBr等合理答案)
2
酸性
H2SeO3+2NaOH=Na2SeO3+2H2O(或其他合理答案)
?
(4) 
本题解析:易推出W、X、Y、Z分别是Si、P、S、Se。
(1)Se比S原子核外多18个电子,根据S的原子结构示意图即可写出Se的原子结构示意图。
(3)H2SeO3与H2SO3相似,具有氧化性、还原性和酸性。
本题难度:一般
2、选择题 日本地震引起的核反应堆爆炸,对我国也产生了一定的影响,其中有131I。下列说法正确的是(?)
A.I元素的相对原子质量为131
B.131I可治疗地方性甲状腺肿大
C.131I与127I两核素互为同位素
D.某溶液中通入过量Cl2,再加入淀粉溶液不变蓝,证明其中没有I-
参考答案:C
本题解析:
正确答案:C
A.不正确,131I质量数为131? B.不正确,131I可预防地方性甲状腺肿大
C.正确,131I与127I两核素互为同位素? D.不正确,某溶液中通入过量Cl2,再加入淀粉溶液不变蓝,过量的氯气能将碘氧化成更高价态的碘。
本题难度:一般
3、选择题 主族元素的化学性质主要取决于
A.元素的化合价
B.原子的质量数
C.原子的最外层电子数
D.原子半径
参考答案:C
本题解析:主族元素的化学性质主要取决于原子的最外层电子数,即价电子数,答案选C。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对原子结构和元素化学性质关系的了解掌握情况,旨在巩固基础,提高学生的应试能力。
本题难度:简单
4、填空题 W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1∶1,Y原子最外层s电子与p电子数之比为1∶1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:________________________。
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为__________<__________(用分子式表示)。
(3)这四种元素原子半径的大小为__________>__________>__________>__________(填元素符号)。
参考答案:(1)2Mg+CO2 2MgO+C
2MgO+C
(2)Mg(OH)2<NaOH
(3)Na>Mg>C>O(说明:顺序全对才给分)
本题解析:Y原子最外层s电子与p电子数之比为1∶1,可能为1s22s22p2或1s22s22p63s23p2;X原子核外s电子与p电子数之比为1∶1,可能为1s22s22p4或1s22s22p63s2,考虑到W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y,X、Y应为1s22s22p2、1s22s22p63s2,即分别为镁和碳;Z原子核外电子中p电子数比Y原子多2个,Z为氧元素;W原子的最外层没有p电子,应为钠。同一周期,元素的最高价氧化物对应水化物的碱性减弱,所以,Mg(OH)2<NaOH,元素周期表中的同周期主族元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,因而Na>Mg>C>O。
本题难度:一般
5、填空题 已知元素的电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性:
?元素
| ? Al?
| ? B?
| ? Be
| ? C
| ? Cl
| ? F
| ? Li
|
电负性
| ?1.61?
| ? 2.04
| ? 1.57
| ? 2.55
| ? 3.16
| ? 3.98
| ? 0.98
|
?元素
| ? Mg
| ? N
| ? Na
| ? O
| ? P
| ? S
| ? Si
|
电负性
| ?1.31
| ? 3.04
| ? 0.93
| ? 3.44
| ? 2.19
| ? 2.58
| ? 1.90
|
(1)根据上表给出数据,可推知元素的电负性具有的变化规律是____________________
(2)预测Br与I元素电负性的大小关系是__________________,电负性最小的元素在周期表中的位置是________________________。(放射性元素除外)
(3)离子化合物和共价化合物之间没有绝对的界限,习惯上把SrI2看作离子化合物,把BaS看作共价化合物。(电负性:Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用△X表示,请找出用△X来判断离子键或共价键的数值范围:
即当△X___________时一般为共价键,当△X___________时一般为离子键。试判断AlBr3中化学键的类型是__________。
参考答案:(1)对同周期元素而言,随核电荷数增加,电负性增大(希有气体元素除外),同主族元素随核电荷数的递增,电负性减小;
(2)Br>I?第六周期第IA主族。(3)≤1.70,≥1.70,共价键。
本题解析:(1)由所给数据可知,对同周期元素而言,随核电荷数增加,电负性增大(希有气体元素除外),同主族元素随核电荷数的递增,电负性减小;
(2)Br与I均为同主族元素,I的核电荷数大,其电负性相对小;
电负性最小的元素,应该在周期表的左下角,在周期表中的位置是:第六周期第IA主族
(3)BaS中△X为2.58—0.89=1.69,SrI2中△X为2.66—0.95=1.71,故当△X≤1.70时一般为共价键,当△X≥1.70时一般为离子键
根据AlCl3中△X为3.16—1.61=1.55,由Cl的电负性大于Br,可推断出AlBr3中△X<1.55,则其中的键为共价键
本题难度:一般