1、选择题 下列说法正确的是(? )
A.第ⅠA族元素都是碱金属元素
B.第ⅦA族元素都是卤族元素
C.氟元素在第ⅦA族,最高正化合价为+7,因此氟的最高价氧化物的分子式为F2O7
D.最外层有两个电子的元素在第ⅡA族
参考答案:B
本题解析:A项,H元素不是金属元素。C项,氟元素无正价。D项,He元素最外层有两个电子,在0族。
本题难度:简单
2、填空题 甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为?;用电子式表示乙与戊形成化合物的过程?。
(2)丙、丁、戊的离子半径由大到小的顺序为?;乙、戊、己的氢化物的还原性最弱的是?。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式?;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为?。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为??。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为:?。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式:?。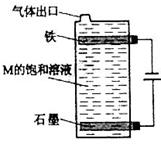
参考答案:(1)?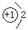 ?(1分)?
?(1分)?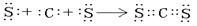 (2分)
(2分)
(2)S2->Na+>Al3+?(2分)? HCl(2分)
(3)H-C≡C-H?(1分)? C2H2 + 4H2O ? 10e-= 2CO2+10H+(2分)
(4)Al(OH)3+OH- =AlO2- +2H2O?(2分);? NaHS+HCl= NaCl+H2S?或 Na2S + H 2S =2 NaHS(2分)
(5)NaCl+H2O NaClO+H2↑?(2分)
NaClO+H2↑?(2分)
本题解析:根据丙、丁、戊处于同一周期,且丙、丁、戊的最高价氧化物的水化物之间都能发生反应,可知丁为Al,该三种元素处于第三周期,氢氧化铝能够与强碱和强酸反应,结合题意,原子序数依次增大的短周期主族元素,推出丙为Na,戊为S,己为Cl;根据乙元素最高化合价与最低价的代数和为0,乙为C元素,甲、丙处于同一主族,甲为H元素。(1)氢的阴离子最外层有2个电子,碳和硫之间以共价键形成CS2;(2)根据电子层数越多半径越大,电子层排布相同的离子,离子半径大小与核电荷数大小成反比,即S2->Na+>Al3+ ,氢化物的还原性与非金属性成反比例,非金属性越强,其氢化物的还原性越弱,其还原性顺序:H2S>CH4>HCl;(3)甲、乙两元素形成的化合物属于烃类,含有极性键又含有非极性键,且相对分子质量最小的物质,含2个碳,含H个数最少,综合判断为乙炔,结构简式为:H-C≡C-H ,乙炔燃料电池,负极是乙炔失去电子发生氧化反应,酸性条件下电极反应式为: C2H2 + 4H2O ? 10e-= 2CO2+10H+;(4)氢氧化钠与氢氧化铝反应离子方程式为Al(OH)3+OH- =AlO2- +2H2O ,H、Na、S、Cl形成的化合物,应该是硫化物(H2S、NaHS或Na2S)和氯化物(HCl和NaCl),其中能发生反应的是NaHS+HCl= NaCl+H2S或Na2S + H 2S =2 NaHS;(5)电解饱和氯化钠溶液,阳极在装置的下部,阳极反应生成的氯气往上溢出的过程中与阴极附近的氢氧化钠反应生成次氯酸钠,起到消毒作用,总电解反应为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
本题难度:一般
3、选择题 已知W、X、Y、Z是短周期元素,aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列说法正确的是
A.离子的还原性:Y2-> Z-
B.原子半径:r(W) > r(X)
C.质子数:c>a
D.W和X两者最高价氧化物对应的水化物能相互反应
参考答案:A
本题解析:依题意推断,四种离子具有28电子层结构,aW2+、bX+、cY2-、dZ-分别为12Mg2+、11Na+、8O2-、9F-,则W、X、Y、Z分别为Mg、Na、O、F;非金属性:O<F,则单质的氧化性:O2<F2,由氧化还原反应规律可知,还原性:8O2->9F-,故A正确;原子半径:Na>Mg,离子半径:Na+> Mg2+,故B错误;c=8,a=12,8<12,则c<a,故C错误;氢氧化镁是中强碱,不是两性氢氧化物,氢氧化钠是强碱,二者不能反应,故D错误。
本题难度:一般
4、选择题 [2012·潍坊一模]X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是(?)
A.X2-的还原性一定大于Y-
B.由mXa+与nYb-得,m+a=n﹣b
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
参考答案:A
本题解析:A项,X与Y位于同一周期,且X位于Y的左边,Y的非金属性大于X,故X2-的还原性一定大于Y-;B项,X原子失去a个电子得mXa+,Y原子得到b个电子形成nYb-得,二者的电子层结构相同,所以,m﹣a=n+b;D项,HnY的稳定性大于HmX。
本题难度:一般
5、填空题 (14分)A、B、C三种元素的原子具有相同的电子层数,且都是短周期元素。已知A是一种金属元素,A原子的最外层电子数为1,它跟酸反应后转化成的A+具有跟Ne相同的电子层结构。B的质子数比A多2个,C的质子数比B多4个。?根据以上条件,填空回答:
(1)C是?元素(写元素名称),画出C原子结构示意图:?。
(2)B元素在周期表中的位置是第?周期,第?族。
(3)C元素的气态氢化物的水溶液呈?(填“酸性”、“碱性”、“中性”)。
(4)A与C形成的化合物的电子式:?。
(5)B元素的最高价氧化物对应的水化物与C元素的气态氢化物的水溶液之间发生的化学反应方程式:?。
参考答案:(14分,每空2分)(1)氯? ?(2)三? ⅢA?(3)酸性
?(2)三? ⅢA?(3)酸性
(4)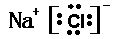 (5)Al(OH)3+3HCl=AlCl3+3H2O
(5)Al(OH)3+3HCl=AlCl3+3H2O
本题解析:根据元素的性质及结构可知,A、B、C三种元素分别是Na、Al、Cl。
(1)氯元素的原子序数是17,位于第三周期第ⅦA,原子结构示意图为 。
。
(2)B是铝元素,原子序数13,位于第三周期第ⅢA族。
(3)氯化物溶于水即得到盐酸,显酸性。
(4)钠和氯气生成离子化合物氧化钠,电子式为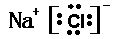 。
。
(5)氢氧化铝是两性氢氧化物,和盐酸反应的方程式为Al(OH)3+3HCl=AlCl3+3H2O。
本题难度:一般