1、选择题 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
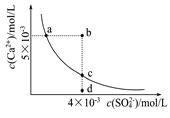
A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
D.向d点溶液中加入适量CaCl2固体可以变到c点
参考答案:B
本题解析:
考查Ksp。Ksp是一个常数,只跟温度有关,温度不变溶度积常数不变。a、c恰好为平衡点,d为不饱和溶液;b为过饱和溶液,将有晶体析出;
B.a点对应的Ksp等于c点对应的Ksp
本题难度:简单
2、填空题 工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
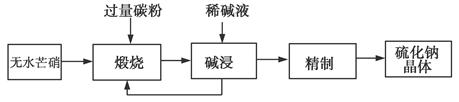
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
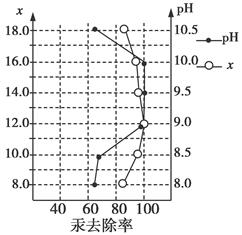
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
参考答案:(1)3Na2SO4+8C 3Na2S+4CO2↑+4CO↑
3Na2S+4CO2↑+4CO↑
(2)热水能促进Na2S水解,而稀碱可抑制Na2S水解
(3)pH介于9~10之间,x=12
(4)4.0×10-36 mol/L
(5)阴极 降低
2Cu2++2e-+H2O=Cu2O↓+2H+
本题解析:(1)由题意分析知反应除生成等物质的量的CO和CO2外还生成Na2S,注意条件为加热。(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解。(3)由图像可知当pH介于9~10时,x=12时汞的除去率最大。(4)pH=4,则c(OH-)=10-10 mol/L,根据Cu(OH)2溶度积可求得c(Cu2+)=2.2 mol/L,代入CuS的溶度积求得c(S2-)=4×10-36 mol/L。(5)Cu由+2价变为+1价,得电子,所以在阴极反应:2Cu2++2e-+H2O=Cu2O↓+2H+,有H+生成,所以溶液的pH降低。
点拨:本题考查化学与技术,考查考生理论联系实际的能力。难度较大。
本题难度:困难
3、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol ?L-1,向该溶液中逐滴加入0.010 mol ?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42-
D.Br-、CrO42-、Cl-
参考答案:C
本题解析:在一定温度下,在难溶化合物的饱和溶液中组成沉淀的各离子的浓度的乘积是一常数,称溶度积常数。运用Ksp的公式进行计算,只要注意到AgCl、AgBr和Ag2CrO4的Ksp表达式不同,计算银离子的浓度即可。
c(Ag+)=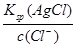 =
=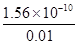 = 1.56×10-8
= 1.56×10-8
c(Ag+)=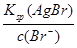 =
=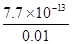 = 7.7×10-11
= 7.7×10-11
c(Ag+)=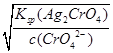 =
=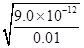 =3.0×10-5
=3.0×10-5
根据计算可知,三种离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,选项C正确。
【考点定位】沉淀溶解平衡、溶度积常数
本题难度:一般
4、选择题 为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的情况下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是( )
A.NH3?H2O
B.NaOH
C.Na2CO3
D.MgO
参考答案:A.除去MgCl2酸性溶液中的Fe3+,在加热搅拌的条件下加入氨水,虽然能形成氢氧化铁沉淀,但同时会形成氢氧化镁沉淀,故A错误;
B.除去MgCl2酸性溶液中的Fe3+,在加热搅拌的条件下加入氢氧化钠,虽然能形成氢氧化铁沉淀,但同时会形成氢氧化镁沉淀,故B错误;
C.Fe3+水解溶液显酸性,Fe3++3H2O?Fe(OH)3+3H+,在加热搅拌的条件下加入碳酸钠,水解吸热,加热搅拌的条件促进水解,碳酸钠和氢离子反应,使三价铁离子的水解平衡向正反应方向移动,使三价铁离子变成氢氧化铁沉淀除去,但同时引入了钠离子,故C错误;
D.Fe3+水解溶液显酸性,Fe3++3H2O?Fe(OH)3+3H+,在加热搅拌的条件下加入碳酸镁,水解吸热,加热搅拌的条件促进水解,碳酸镁和氢离子反应生成镁离子和CO2,使三价铁离子的水解平衡向正反应方向移动,使三价铁离子变成氢氧化铁沉淀除去,同时实现将杂质转化为纯净物,故D正确;
故选D.
本题解析:
本题难度:简单
5、简答题 制取纯净的氯化铜晶体(CuCl2?2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.
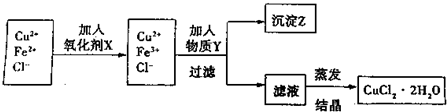
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Cu2+
4.7
6.7
|
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是______.(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是______.②写出沉淀Z在水中的沉淀溶解平衡方程式:______.
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是______.
(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为______.(填“原电池”或“电解池”)②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液.
(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS
Ksp
6.3×10-18
2.5×-13
1.3×10-36
3.4×10-28
6.4×10-53
1.6×10-24
|
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的______除去它们.(选填序号)
①NaOH? ②FeS? ③Na2S.
参考答案:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故答案为:C;
(2)①结合题示,调节pH至4~5,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3;
②沉淀Z为Fe(OH)3,在溶液中存在溶解平衡:Fe(OH)3(s)?

?Fe2+(aq)+3OH-(aq),故答案为:Fe(OH)3(s)?

?Fe2+(aq)+3OH-(aq);
(3)CuCl2溶液在蒸发结晶过程中发生水解,为抑制其水解,根据Cu2++2H2O

Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干.
故答案为:在HCl气流下加热浓缩,冷却结晶;
(4)①Cu与盐酸不反应,为使反应Cu+2H+═Cu2++H2↑发生,应设计成电解池,铜作阳极,故答案为:电解池;
②将反应Cu+2H+═Cu2++H2↑设计成电解池,可将铜作阳极,碳棒或铂为阴极,盐酸为电解质,设计电解池为
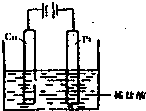
,
故答案为:

;
(5)①加入NaOH,易生成Hg(OH)2,Hg(OH)2不稳定,易分解最终生成有害物质Hg,并且加入NaOH成本较大,过量时引入新的杂质,②FeS较HgS、CuS易溶,加入FeS,可易生成HgS、CuS而除去溶液中的Cu2+、Pb2+、Hg2+,③加入Na2S,过量时易引入S2-杂质,所以只有②符合.
故答案为:②.
本题解析:
本题难度:一般