1、填空题 (1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为?。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是?(用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N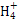 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
参考答案:(1)107∶1? (2)②>③>④>①? (3)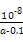
本题解析:(1)0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好生成NaA,水解促进水的电离,已知pH=8,故由水电离出的c(OH-)=10-6;NaOH抑制水的电离,0.1 mol·L-1 NaOH溶液的c(OH-)="0.1" mol·L-1,故由水电离出的c(OH-)=c(H+)=10-13,两者之比为107∶1。(2)一定温度下,c(S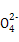 )·c(Ba2+)为定值,c(S
)·c(Ba2+)为定值,c(S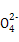 )越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N
)越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N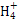 )=c(OH-)+c(Cl-),已知c(N
)=c(OH-)+c(Cl-),已知c(N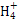 )=c(Cl-)=
)=c(Cl-)=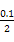 ?mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N
?mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N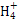 )=
)= ?mol·L-1,故c(NH3·H2O)=
?mol·L-1,故c(NH3·H2O)=
 -
-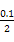
 ?mol·L-1=
?mol·L-1=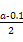 ?mol·L-1。代入Kb=
?mol·L-1。代入Kb=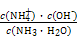 =
=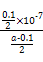 =
=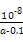 。
。
本题难度:简单
2、选择题 下列有关沉淀溶解平衡的说法正确的是( )
A.KSP(AB2)小于KSP(CD),则物质AB2的溶解度一定小于物质CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
参考答案:A、因比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比较,不能通过溶度积直接比较,故A错误;
B、因难溶盐电解质的Ksp与温度有关,不受其他因素的影响,所以加入蒸馏水,氯化银的KSP不变,故B错误;
C、因氯化银的溶度积大于碘化银的溶度积,所以氯化银沉淀可转化为碘化银沉淀,故C正确;
D、碳酸根离子与酸反应生成二氧化碳和水,生成物的浓度减小,碳酸钙的沉淀溶解平衡正向移动,故D错误;
故选:C.
本题解析:
本题难度:简单
3、选择题 已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与Pb(NO3)2溶液按体积比为2:1混合,则生成PbI2沉淀所需Pb( NO3)2溶液的最小浓度(mol/L)为
?[? ]
A.8.4×10-4
B.5.6×10-4
C.4.2×10-4
D.2.8×10-4
参考答案:A
本题解析:
本题难度:一般
4、简答题 硫酸钙是一种用途非常广泛的产品.
(1)25℃时,Ksp(CaSO4)=7.10×10-5.在1L0.1mol?L-1CaCl2溶液中加入1L0.2mol?L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为______mol?L-1.
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4?yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示.

①x:y=______.
②t2~t3时间段固体的化学式为______.
③t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为______.
参考答案:(1)1L0.1mol?L-1CaCl2溶液中加入1L0.2mol?L-1的Na2SO4溶液,充分反应后,Na2SO4过量,
反应后溶液中c(SO42-)=1L×0.2mol/L-1L×0.1mol/L2L=0.05mol/L,
又:Ksp(CaSO4)=c(Ca2+)×c(SO42-)=7.10×10-5,
c(Ca2+)=7.10×10-50.05mol/L=1.42×10-3mol/L,
故答案为:1.42×10-3;
(2)①在加热到t1时xCaSO4?yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,
则m(H2O)=3.26g-2.72g=5.4g,m(CaSO4)=2.72g,
n(H2O)=5.4g18g/mol=0.3mol,n(CaSO4)=2.72g136g=0.2mol,
所以n(CaSO4):n(H2O)=x:y=0.2:0.3=2:3,
故答案为:2:3;
②生石膏在加热条件下失去部分水生成熟石膏,熟石膏的主要成分为2CaSO4?H2O 或CaSO4?12H2O,
故答案为:2CaSO4?H2O 或CaSO4?12H2O;?
③在t4时完全生成CaSO4,在t5~t6时间段温度较高,CaSO4开始分解,产生了两种气体,其中一种能使品红溶液褪色,则该气体为二氧化硫,反应的方程式为2CaSO4?高温?.?2CaO+2SO2↑+O2↑,
故答案为:2CaSO4?高温?.?2CaO+2SO2↑+O2↑.
本题解析:
本题难度:一般
5、选择题 有关AgCl的沉淀溶解平衡的说法中,不正确的是( )
A.AgCl难溶于水,溶液中没有Ag+和Cl-
B.升高温度时,AgCl的溶解度增大
C.向AgCl饱和溶液中,加入NaCl固体,会析出AgCl固体
D.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
参考答案:A、AgCl难溶于水,但溶液中存在溶解平衡,饱和溶液中有Ag+和Cl-,故A错误;
B、温度升高增大氯化银的溶解度,故B正确;
C、沉淀溶解平衡状态存在溶度积常数,随温度变化,加入氯化钠,增大氯离子浓度平衡沉淀方向进行,生成氯化银沉淀,故C正确;
D、氯化银在水中难溶形成饱和溶液,存在沉淀溶解平衡,是动态平衡,沉淀溶解速率相等,故D正确;
故选A.
本题解析:
本题难度:简单