1、选择题 氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为
0.1 mol·L-1的4种钠盐溶液的pH如下表:
溶质
| Na2CO3
| NaHCO3
| NaClO
| NaHSO3
|
pH
| 11.6
| 9.7
| 10.3
| 5.2
|
?
下列说法中正确的是(?)
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS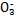 )>c(S
)>c(S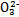 )>c(OH-)
)>c(OH-)
参考答案:A
本题解析:不同的弱酸与同种碱发生反应得到的盐的水溶液的pH关系是:酸越强,盐溶液的pH就越小,酸越弱,相应的盐溶液的pH就越大。A.向氯水中加入NaHCO3溶液,由于在氯水中存在平衡:Cl2+H2O HCl+HClO,由于酸性HCl> H2CO3> HClO,所以会发生反应NaHCO3+HCl=NaCl+H2O+ CO2↑,使Cl2+H2O
HCl+HClO,由于酸性HCl> H2CO3> HClO,所以会发生反应NaHCO3+HCl=NaCl+H2O+ CO2↑,使Cl2+H2O HCl+HClO正向移动,c(HClO)增大。正确。B.在四种溶液中,由于Na2CO3的pH最大,所以水的电离程度最大的是Na2CO3。错误。C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,电离程度最大的是H2SO3。酸的电离程度越大,c(H+)越大,溶液的pH越小。所以pH最大的是HClO溶液.错误。D.在NaHSO3溶液中,存在电离:NaHSO3=Na++ HSO3-,电离平衡:HSO3-
HCl+HClO正向移动,c(HClO)增大。正确。B.在四种溶液中,由于Na2CO3的pH最大,所以水的电离程度最大的是Na2CO3。错误。C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,电离程度最大的是H2SO3。酸的电离程度越大,c(H+)越大,溶液的pH越小。所以pH最大的是HClO溶液.错误。D.在NaHSO3溶液中,存在电离:NaHSO3=Na++ HSO3-,电离平衡:HSO3- H++ SO32-。水解平衡:HSO3-+H2O
H++ SO32-。水解平衡:HSO3-+H2O OH-+ H2SO3。由于在NaHSO3溶液中,pH=5.2.说明HSO3-的电离作用大于水解作用。但是盐的电离作用大于弱电解质的电离作用,所以在此溶液中各种离子浓度大小顺序为c(Na+)> c(HSO3-)> c(H+)>c(SO32-)>c(OH-)。错误。
OH-+ H2SO3。由于在NaHSO3溶液中,pH=5.2.说明HSO3-的电离作用大于水解作用。但是盐的电离作用大于弱电解质的电离作用,所以在此溶液中各种离子浓度大小顺序为c(Na+)> c(HSO3-)> c(H+)>c(SO32-)>c(OH-)。错误。
本题难度:一般
2、选择题 一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
[? ]
A.加入少量NaOH固体,c(CH3COO-)增大
B.加入少量FeCl3固体,c(CH3 COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量醋酸得到的酸性混合溶液:c( Na+) >c(CH3COO-)>c(H+) >c( OH-)
参考答案:AB
本题解析:
本题难度:一般
3、选择题 下列说法正确的是(? )
A.酸式盐的水溶液一定显碱性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和OH-离子的物质的量浓度相等
D.NaHCO3溶液的PH大于Na2SO4溶液的PH
参考答案:C
本题解析:酸式盐的水溶液有的显碱性,也有的酸性,如HCO3-和HSO3-;即使是强酸与强碱的物质的量浓度和体积分别相等,它们反应后的溶液也不一定呈中性,如NaOH与H2SO4,弱酸与弱碱的反应后的溶液也不一定呈中性。
本题难度:一般
4、选择题 下列有关判断正确的是( )
A.0.1 mol·L-1Na2SO3溶液中有c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
B.0.1 mol·L-1NH4Fe(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Fe3+)=c(NH4+)>c(H+)>c(OH-)
C.0.2 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合后有c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合得到的溶液一定呈酸性
参考答案:C
本题解析:SO32-发生水解,则由物料守恒可得c(Na+)
=2c(SO32-)+2c(HSO3-)+2c(H2SO3),A错误;NH4Fe(SO4)2溶液中,Fe3+、NH4+的水解能力不同,故c(NH4+)不等于c(Fe3+),B错误;依据电荷守恒可知C正确;题给两种溶液混合后得到等浓度的NaA和HA溶液,若HA的电离程度小于A-的水解程度,则溶液呈碱性,D错误。
本题难度:一般
5、选择题 Na2CO3水溶液中存在CO32-?+?H2O HCO3-?+OH-平衡。下列说法不正确的是
HCO3-?+OH-平衡。下列说法不正确的是
[? ]
A.稀释溶液,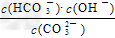 增大?
增大?
B.通入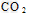 ,溶液pH减小
,溶液pH减小
C.升高温度,此平衡常数增大?
D.加入NaOH固体,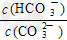 减小
减小
参考答案:A
本题解析:
本题难度:一般