1、选择题 第十一届全运会济南奥体中心游泳馆的水质达剑国际泳联最新卫生标准,泳池的水采用砂滤一臭氧一活性炭净水工艺进行处理,其中砂滤、臭氧、活性炭的作用分别是(?)
A.吸附、消毒、过滤
B.杀菌、漂白、吸附
C.过滤、漂白、吸附
D.过滤、消毒、吸附
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是( )
A.用漂白粉等氯制消毒剂杀灭甲流病毒,是因为氯能与病毒发生化合反应
B.能发生银镜反应的有机物一定属于醛
C.淀粉和纤维素的化学式均可写成(C6H10O5)n,它们互为同分异构体
D.肥皂的有效成分是经皂化反应生成的高级脂肪酸钠
参考答案:A、因漂白粉能与空气中的CO2和H2O反应:Ca(ClO)2+CO2+H2O=CaCO3 +2HClO,产生的HClO具有强氧化性而用于杀菌消毒,则与病毒发生氧化还原反应,故A错误;
B、因能发生银镜反应的物质必须有醛基,而含有醛基的物质有:醛、甲酸、甲酸盐、甲酸某酯、葡萄糖等,故B错误;
C、因同分异构体的分子式相同,结构不同,而淀粉和纤维素的化学式均可写成(C6H10O5)n,但n不相同,所以分子式不同,故C错误;
D、因油脂在碱性条件下水解得到高级脂肪酸钠和甘油,该反应称为皂化反应,工业上利用这反应来制备肥皂,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 检验HCl气体中是否混有Cl2,可采用的方法是?(? )
A.用干燥的蓝色石蕊试纸
B.用干燥的有色布条
C.将气体通入AgNO3溶液中
D.用湿润的淀粉碘化钾试纸
参考答案:D
本题解析:A 、B 错误,因为纸条或布条是干燥的,不会反应。
C 错误,HCl气体也可以使AgNO3溶液产生白色沉淀。
D 正确,Cl2能使湿润的淀粉碘化钾试纸变蓝,HCl不能。
本题难度:简单
4、选择题 下列说法正确的是? ( )。
A.实验室可用加热分解碳酸钙的方法制取二氧化碳气体
B.二氧化硫易溶于水,硫酸工厂的尾气可以直接用水吸收
C.二氧化氮可与水反应而被吸收,故硝酸工业的尾气应该用水吸收
D.配制较高浓度的碘水时,应先将碘溶于酒精中,再加水稀释
参考答案:D
本题解析:CaCO3分解的温度较高,不适合实验室制CO2,A错误;工业上是用碱液来吸收二氧化硫气体的,B错误;水与二氧化氮反应的同时会产生NO,C错误;碘在酒精中的溶解度大,而酒精与水能以任意比互溶,故D正确。
本题难度:一般
5、填空题 浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:?。
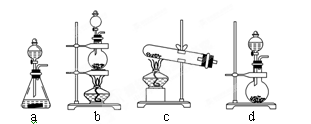
(2)实验室用二氧化锰制取氯气的化学方程式为:?;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气?(填写装置的序号)。
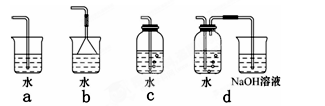
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:?;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是?(选填下列选项的编号字母)。
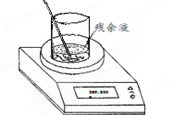
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
CaCO3用量
| 未加CaCO3时
| 加约四分之一时
| 加一半时
| 全部加完时
|
读数/g
| 318.3
| 325.3
| 334.5
| 359.5
|
请你据此分析计算:
①实验中产生的CO2气体质量为?;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位)?。
参考答案:(1)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(2)MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑(2分);b(1分)
MnCl2+2H2O+Cl2↑(2分);b(1分)
(3)2Br-+Cl2=2Cl-+Br2(2分);d(1分) (4)①8.8g(2分);②4.0mol/L(3分)
本题解析:(1)“氯碱工业”是以食盐水为原料,通过电解法制取Cl2等物质,有关的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)实验室用二氧化锰制取氯气的化学方程式为MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
MnCl2+2H2O+Cl2↑。根据方程式可知该反应是固体与液体加热制备气体,因此需要的主要仪器是酒精灯、分液漏斗、烧瓶,则实验装置应该是装置b,即答案选b。
(3)氯气的氧化性强于单质溴的,能把溴离子氧化生成单质溴,所以Br—→Br2的转化离子方程式为2Br-+Cl2=2Cl-+Br2。氯气能溶于水,但溶解度很小。另外氯气有毒,需要尾气处理,可以用氢氧化钠溶液吸收,因此正确的答案选d。
(4)①根据质量守恒定律可知,反应中产生CO2的质量=318.3g+50.0g-359.5g=8.8g。
②CO2的物质的量=8.8g÷44g/mol=0.2mol,则根据方程式可知
CaCO3+2HCl=CaCl2+H2O+CO2↑
2mol? 1mol
0.4mol? 0.2mol
所以盐酸的浓度=0.4mol÷0.1L=4.0mol/L
本题难度:一般