| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《焓变、反应热》高频试题强化练习(2019年最新版)(六)
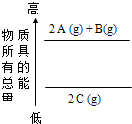 参考答案:由图象知,2A+B的能量大于2C的能量,根据化学反应前后能量守恒,如果A、B为反应物,C为生成物,2A(g)+B(g)═2C(g)时该反应放出能量,△H=a<0;如果C为反应物,A、B为生成物,2C(g)═2A(g)+B(g)时该反应吸收能量,△H=a>0.反应的能量变化和物质的聚集状态有关,图象中物质是气体,所以要标注物质聚集状态,才能标注反应热;综上所述分析得到,B正确; 本题解析: 本题难度:一般 5、填空题 目前,消除氮氧化物污染有多种方法。 参考答案: 本题解析:(1)根据盖斯定律可知,①+②+③即得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1。(2) ①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确;根据方程式可知,反应前后体积是不变的,所以压强始终是不变的,则a不能说明;b中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的;②反应进行到40min时,各种物质的浓度不再发生变化,说明反应已经达到平衡状态,则该反应的平衡常数K= 本题难度:困难 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《有机合成与.. | |