1、填空题 (6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
温度/℃
| 1538
| 1760
| 2404
|
平衡常数K
| 0.86×10-4
| 2.6×10-4
| 64×10-4
|
?该反应的△H?0(填“>”、“=”或“<”)。
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g) 2NO(g)达到平衡时N2的浓度为?。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时N2的浓度为?。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g)?DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH=?。?(用含a的代数式表示)
2、选择题 1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
3、选择题 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)?+?OH-(aq)=?H2O(l)?△H=-57.3kJ/mol。向1L?0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸?②浓硫酸?③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是?
[? ]
A.△H1>△H2>△H3?
B.△H1<△H3<△H2
C.△H1<△H2<△H3
D.△H1>△H3>△H2
4、选择题 下列有关化学与能量的说法不正确的是
[?]
A.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq) =NaCl(aq)+H2O(l) △H=+57.3kJ/mol
B.化石燃料和植物燃料燃烧时放出的能量来源于太阳能
C.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
D.同一化学反应,化学计量数不同,△H值不同,化学计量数相同而状态不同,△H值也不相同
5、填空题 (I某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:

(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是? _?。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成 N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_?。
(B)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术
将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2?△H
2CO2+ N2?△H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
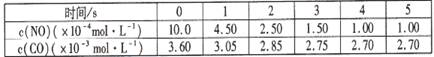
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H?0(填写“>”、“<”、“=”)
(2)在该温度下,反应的平衡常数K=?(只写出计算结果);
(3)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,
部分实验条件如下表:

该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号; 