1、选择题 下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由“C(石墨)→C(金刚石)△H=+1.9KJ/mol”可知,金刚石比石墨稳定
C.反应是放热的还是吸热的必须看反应物和生成物所具有的总能量的相对大小
D.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H20(l)△H=+285.8KJ/mol
参考答案:A、等量的硫蒸气和硫固体分别完全燃烧,固体变化为气体需要吸热,后者放出的热量少,故A错误;
B、热化学方程式可知能量越高,越活泼;石墨能量低于金刚石,石墨稳定,故B错误;
C、依据反应能量守恒,化学反应的吸热放热判断,可以用反应物与生成物的总能量比较,故C正确;
D、2gH2物质的量为1mol,完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:H2(g)+12O2(g)=H20(l)△H=+285.8KJ/mol,故D错误;
故选C.
本题解析:
本题难度:简单
2、填空题 已知:在热力学标准态(298 K、1.01×105 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。下图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题
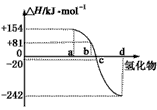
(1)归纳:非金属元素氢化物的稳定性与氢化物的反应热ΔH的关系____________。
(2)硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:__________________________。
参考答案:(1)非金属元素氢化物越稳定,ΔH越小,反之亦然
(2)H2Se(g)=Se(s)+H2(g) ΔH=-81 kJ·mol-1
本题解析:
本题难度:一般
3、选择题 强酸与强碱的稀溶液发生中和反应的热效应为:?H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1分别向1L?0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是?
[? ]
A.△H1>△H2>△H3?
B.△H1<△H2<△H3
C.△H1>△H2=△H3?
D.△H1=△H2<△H3
参考答案:B
本题解析:
本题难度:一般
4、填空题 据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。
(1)常温、常压下,等体积的丙烷和丁烷完全燃烧恢复到原状态,生成二氧化碳的体积比为_______。
(2)已知丁烷的燃烧热为2880 kJ/mol,1 mol丙烷和丁烷(物质的量之比1∶1)的混合气完全燃烧生成液态水时放出的热量为2550 kJ。写出丙烷燃烧的热化学方程式__________________________。
(3)2SO2(g)+O2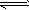 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的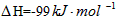 。
。
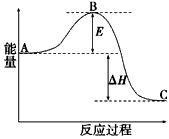
请回答下列问题:图中A、C分别表示__________、___________,E的大小对该反应的反应热有无影响?
_________。
参考答案:(1)3:4
(2)C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) △H=-2220kJ/mol
(3)反应物能量;生成物能量;没有影响
本题解析:
本题难度:一般
5、选择题 已知C(石墨)→C(金刚石),ΔH=+119KJ/mol,则可判断
[? ]
A.金刚石比石墨稳定
B.一样稳定
C.石墨比金刚石稳定
D.无法判断
参考答案:C
本题解析:
本题难度:简单