1、选择题 一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g) 2C(g)?经2分钟反应达到平衡,此时生成0.2mol C。
2C(g)?经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是?(?)

A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
参考答案:C
本题解析:
解本题学生应明确化学反应速率的基本公式V=△C÷△t 和化学反应速率的表示规律;外在条件对化学平衡移动方向的影响。
知有反应? A(g)+3B(g) 2C(g)
2C(g)
始? 1? 2? 0? mol
2分钟末? 1-0.1? 2-0.3? 0.2? mol
变化? 0.1? 0.3? 0.2? mol
A应为:V(B)=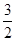 V(C)=
V(C)= 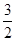 ×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
B应为:2分钟末A的转化率为 = 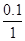
 100% =" 10%"
100% =" 10%"
C:正确。升高温度从图中可见:逆反应速率增大的倍数大于正反应速率增大的倍数,平衡向逆反应方向移动,即逆反应吸热,正反应放热。
D:错误,本反应反应物气体系数和为4,生成物气体系数为2,增大压强平衡向气体体积减小的方向移动。应为,正反应速率增大的倍数大于逆反应速率增大的倍数。
本题难度:简单
2、选择题 在密闭容器中冲入4mol?SO2和3mol?O2?一定条件下建立平衡2SO2(g)+O2(g)?2SO3(g)△H=-Q?KJ/mol,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A.1.8Q?KJ
B.2Q?KJ
C.Q?KJ
D.0.9Q?KJ
参考答案:设反应放出的热量为x,
由2SO2(g)+O2(g)?2SO3(g)△H=-Q?KJ/mol
? 2? QkJ
?4mol×90%? x
24mol×90%=QkJx,
解得x=1.8QkJ,
故选A.
本题解析:
本题难度:一般
3、选择题 在一定温度下,将等物质的量A和B充入一密闭容器中,发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若A和B的物质的量之和与C相等,则此时A的转化率为
2C(g),反应达到平衡时,若A和B的物质的量之和与C相等,则此时A的转化率为
[? ]
A.50%
B.60%
C.40%
D.70%
参考答案:C
本题解析:
本题难度:一般
4、选择题 相同温度下,体积均为0.25?L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g)?△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表
2NH3(g)?△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表

下列叙述错误的是?
[? ]
A.容器①、②中反应的平衡常数相等?
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15?kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
参考答案:C
本题解析:
本题难度:一般
5、简答题 SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)?2SO3(g)△H<0.若向一个2L的密闭容器中充入0.4mol?SO2、0.2mol?O2和0.4mol?SO3发生上述反应.
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为______.
(3)某温度时,将4mol?SO2和2mol?O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=______,该温度下反应2SO2(g)+O2(g)?2S03(g)的平衡常数K=______.
参考答案:(1)SO2、O2、SO3起始浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,
A、SO2和O2的浓度增大,SO2、O2的浓度增大分别为0.1mol/L、0.05mol/L,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,实际变化应小于该值,且为2:1,故A可能;
B.SO3的浓度增大,浓度增大为0.2mol/L,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故B不可能;
C.SO2、O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,实际变化应小于该值,故C不可能;
D.SO3的浓度增大,浓度增大为0.1mol/L,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故D可能;
故答案为:AD;
(2)选则A计算平衡常数,SO2、O2的浓度增大分别为0.1mol/L、0.05mol/L,则SO3的浓度减少量为0.1ml/L,故平衡时SO3的浓度为0.2mol/L-0.1ml/L=0.1mol/L,故平衡常数k=0.120.32×0.15=0.74;
故答案为:0.74;
(3)SO2的转化率为80%,则参加反应的SO2为4mol×80%=3.2mol,故参加反应的O2为3.2mol×12=1.6mol,故v(O2)=1.6mol2L10min=0.08mol/(L?min);
计算SO2、O2的起始浓度分别为2mol/L、1mol/L,SO2的浓度变化量为3.2mol2L=1.6mol/L,则:
? 2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):2? 1? 0
变化(mol/L):1.6? 0.8? 1.6
平衡(mol/L):0.4? 0.2? 1.6
故该温度下平衡常数k=1.620.42×0.2=80,
故答案为:0.08mol/(L?min);80.
本题解析:
本题难度:一般